
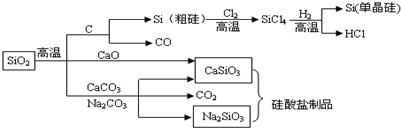
| A. | 图中所有的反应中,属于氧化还原反应的有3个 | |
| B. | 用硫酸可以除去石英砂(主要成分是SiO2)中少量的碳酸钙 | |
| C. | 工业制水泥、工业制玻璃、燃煤固硫等都用到原料石灰石 | |
| D. | 纯净的二氧化硅和单晶硅都是信息产业的重要基础原料,高纯度二氧化硅的广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
分析 A.化学反应前后有元素化合价变化的一定是氧化还原反应;
B.硫酸与碳酸钙反应生成硫酸钙,附着在碳酸钙的表面;
C.水泥的原料:石灰石、粘土等,玻璃的原料:石英、纯碱、石灰石等,通过向燃煤中加生石灰或石灰石固硫;
D.光导纤维的主要成分是二氧化硅,二氧化硅能与氢氧化钠溶液反应生成硅酸钠和水.
解答 解:A.二氧化硅与碳的反,硅和氯气的反应,四氯化硅和氢气的反应,是氧化还原反应,故A正确;
B.硫酸与碳酸钙反应生成硫酸钙,附着在碳酸钙的表面,阻止反应的进一步进行,故B错误;
C.工业制水泥、玻璃的原料用到石灰石,煤中含硫燃烧后生成二氧化硫属于污染空气的有害气体,通过向燃煤中加生石灰或石灰石固硫,可除去硫元素,故C正确;
D.二氧化硅能用于制光导纤维、二氧化硅能与氢氧化钠溶液反应生成硅酸钠和水,所以光导纤维遇强碱会“断路”,故D正确.
故选B.
点评 本题考查硅和二氧化硅的性质和用途,题目难度不大,注意只有纯净物有固定的熔沸点.


科目:高中化学 来源: 题型:解答题
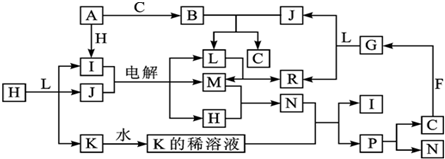
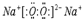 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2C(CH3)2CH(C2H5)CH3:2-乙基-3,3-二甲基戊烷 | |
| B. | HC≡C-CH2CH(CH3)-CH3:2-甲基-5-戊炔 | |
| C. | CH3CHClCH2CHClCH2CH2Cl:2,4,6-三氯己烷 | |
| D. | CH3CHOHCH2CHOHCHOHCH3:2,3,5-己三醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
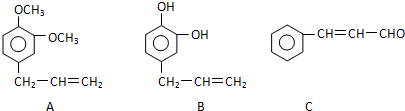
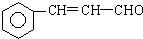 +5H2$\stackrel{一定条件下}{→}$
+5H2$\stackrel{一定条件下}{→}$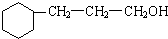 .
.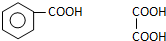 .
.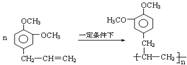 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题:
已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓ | |
| C. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O--→2C6H5OH+CO32- | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用作木材的防火剂 | |
| B. | Na2O2可用于潜水员的呼吸面具中的供氧剂 | |
| C. | 对“地沟油”蒸馏可以获得汽油 | |
| D. | 石英具有很好的导光性,可用于生产光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com