
【题目】运用现代科技从苦艾精油中分离出多种化合物,其中四种的结构如下:
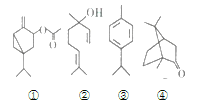
下列说法不正确的是( )
A.②③分子中所有碳原子不可能处于同一平面内
B.②④互为同分异构体
C.④的一氯代物有6种
D.①②③均能使酸性高锰酸钾溶液褪色
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如表
T/K | 938 | 1100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态、若降低温度,混合气体的平均相对分子质量__________________;充入氮气,混合气体的密度__________________(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1mol·的下列五种溶液的pH如下表
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,水解能力最弱的是__________________。
②根据表中数据判断,浓度均为0.01mol·L-1的下列四种物质的溶液分别稀释100倍,pH变化最小的是_______(填编号)
A. HClO B. HCN C.H2CO3 D. CH3COOH
③据上表数据,请你判断下列反应不能成立的是_______(填编号)
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入碳酸氢钠,反应的离子方程式为______________
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀指示到达滴定终点当溶液中Cl恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为_______mol·L-1,此时溶液中c(CrO42-)等于_______mol·L-1.(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某淡黄色固体A(仅含三种元素,式量小于160)可用于制药,为探究其组成和性质,设计并完成如下实验:
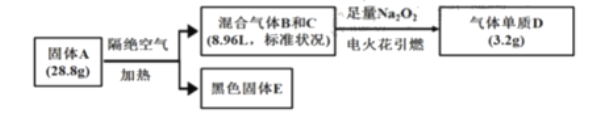
已知:①上述流程中所涉及的反应都充分进行。
②B、C、D均为常见气体。相同情况下气体B的密度大气体C。
③黑色固体![]() 溶于盐酸后滴加KSCN,无明显现象,加适量氯水后,溶液变红。
溶于盐酸后滴加KSCN,无明显现象,加适量氯水后,溶液变红。
请问答:
(1)写出气体B的电子式__,固体A的化学式是__。
(2)黑色固体E与足量浓硝酸反应的离子反应方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年“两会”政府工作报告指出:开展蓝天、碧水、净土保卫战。煤的综合利用 可减少直接燃烧造成的污染。下列有关煤干馏的产品说法正确的是
A.![]() 和
和![]() 互为同系物
互为同系物
B.甲烷能被氧气或酸性高锰酸钾溶液氧化
C.CH2=CH2 水化制乙醇属于取代反应
D.![]() 的一氯代物共有 3 种
的一氯代物共有 3 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中含锰元素的主要矿物有软锰矿(MnO2·xH2O)、黑锰矿Mn3O4,大洋底部有大量锰结核矿。锰元素在多个领域中均有重要应用,用于制合金,能改善钢的抗冲击性能等。
(1)Mn在元素周期表中位于___区,核外电子占据最高能层的符号是___,金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用“___理论”解释。
(2)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是___。
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn2+中不含成对电子
C.第四周期元素中,锰原子价电子层中未成对电子数最多
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(3)在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为__。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为__。
(4)二价锰的化合物MnO和MnS熔融态均能导电,熔点MnO___MnS(选填“高于”、“等于”、“低于”)并解释原因___。
(5)某锰氧化物的晶胞结构如图:
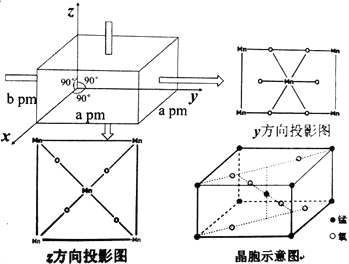
该锰的氧化物的化学式为___,该晶体中Mn的配位数为____,该晶体中Mn之间的最近距离为___pm(用a、b来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法错误的是( )
A.18g 氨基(-N2H2)中含有的电子数为 9 NA
B.32g Cu 在足量O2或硫蒸气中完全反应失去的电子数均为NA
C.用惰性电极电解 100mL 0.1mol·L-1的 CuSO4 溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数为 0.04 NA
D.等物质的量的FeBr2 和Cl2 在溶液中的反应 Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述述正确的是()
CH3COO-+H+,对于该平衡,下列叙述述正确的是()
A.加入水时,平衡向右移动,CH3COOH电离常数增大
B.加入少量CH3COONa固体,平衡向右移动
C.加入少量NaOH固体,平衡向右移动,c(H+)减少
D.稍微升高溶液温度,溶液中的c(OH-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为__________。
②工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的链能相同),则该反应的△H=______________。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
③一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_________________。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40 min内用NH3的浓度变化表示的平均反应速率v(NH3)=______________。
②该反应的△H________0(填“>”或“<”) ,理由是____________________。
③对该反应,下列说法正确的是______________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内C12和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl
NHCl2(l)+2HCl(g),测得平衡时Cl

①A、B、C三点中Cl2转化率最高的是______点(填“A”“B”或“C”)。
②计算C点时该反应的压强平衡常数Kp(C)=_______(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com