
| O | 2-3 |
| O | 2-4 |
| O | 2-4 |
| O | 2-3 |
| O | 2-4 |
| A.①②③④ | B.①④ | C.②③④ | D.②③ |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:不详 题型:单选题
| 实例 | 物质性质差异 | 分离方法 |
| ①除去氯化钠溶液中的泥沙 | a在水中溶解度的差异 | 甲 蒸馏 |
| ②用四氯化碳提取溴水中的溴单质 | b在不同溶剂中溶解度的差异 | 乙 萃取 |
| ③分离乙酸(沸点118°C)与乙酸乙酯(沸点77.1°C) | c沸点的差异 | 丙 分液 |
| ④分离汽油和水 | d互不相溶 | 丁 过滤 |
| ⑤从含少量氯化钠的硝酸钾溶液中提取硝酸钾 | e溶解度随温度变化的差异 | 戊 结晶 |
| A.①a和③c丙 | B.②b乙和⑤e戊 | C.④d丁和⑤e戊 | D.①a和④d丁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加热,用湿润的红色石蕊试纸检验 |
| B.加水溶解,用红色石蕊试纸检测溶液酸碱性 |
| C.加入弱碱溶液,加热,滴入酚酞试剂 |
| D.加入烧碱溶液,加热,用湿润的红色石蕊试纸检验 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第一步:向溶液中滴加过量的盐酸溶液,其目的是检验CO32-并将其除去 |
| B.第二步:加入过量的氯化钡溶液并过滤,其目的是检验并除去其中含有的SO42- |
| C.第一步应先加入硝酸银溶液检验氯离子 |
| D.第一步和第二步应该分别加入硝酸和硝酸钡溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.焰色反应实验后,用稀硫酸洗净铂丝,灼烧至无色,以除去残留在铂丝上的试剂 |
| B.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则该溶液一定含有Ag+ |
| C.欲除去氯气中少量氯化氢气体,可将此混合气体通过盛饱和食盐水的洗气瓶 |
| D.托盘天平称取58.50g食盐,加1升水配制成溶液,NaCl溶液浓度为1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| O | 2-3 |
| O | 2-4 |
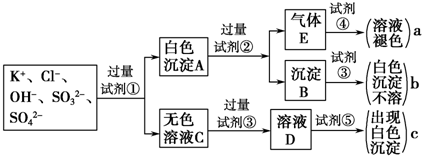
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体(n)的关系如图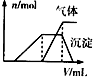 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com