
以铬铁矿为原料制备铬酸钾(K2Cr2O7)的工艺流程如下图所示。铬铁矿的主要成分可表示为FeO-Cr2O3和杂质SiO2。
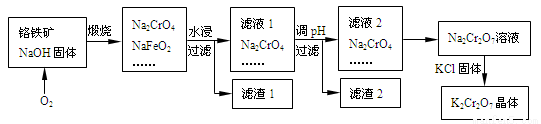
已知:①NaFeO2遇水强烈水解
②2CrO42-+2H+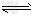 Cr2O72-+H2O
Cr2O72-+H2O
回答下列问题:
(1)K2CrO4中Cr元素的化合价是________。
(2)完成并配平煅烧铬铁矿生成Na2CrO4和NaFeO2的化学反应方程式________
FeO-Cr2O3+ O2+ NaOH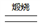 Na2CrO4+NaFeO2+ ;
Na2CrO4+NaFeO2+ ;
该反应的氧化产物是________。
(3)生成滤渣1中红褐色物质的化学反应方程式是____________。滤渣2的成分(填化学式)_______。
(4)滤液2存在平衡:2CrO42-(黄色)+2H+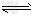 Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是______。
Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是______。
A.达到新平衡后,溶液PH一定增大
B.再达到新平衡前,正反应速率一定大于逆反应速率
C.该反应平衡常数可以不改变
D.达新平衡后,CrO42-的消耗速率等于Cr2O72-的消耗速率
(5)含铬废水中含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的危害,必须进行处理。还原沉淀法是常用的一种方法:
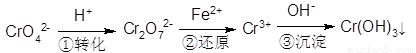
①上述流程中还原过程的离子反应方程式为:_______________。
②最终生成的Cr(OH)3在溶液中存在沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH—(aq)常温下,Cr(OH)3的Ksp=1×10-32,当c(Cr3+)降至1×10-3·mol·L-1,溶液的pH应调至4时______(填“有”或“没有”)沉淀生成。
Cr3+(aq)+3OH—(aq)常温下,Cr(OH)3的Ksp=1×10-32,当c(Cr3+)降至1×10-3·mol·L-1,溶液的pH应调至4时______(填“有”或“没有”)沉淀生成。
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源:2017届山东省菏泽市高三一模理综化学试卷(解析版) 题型:简答题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,工业上生产亚氯酸钠和高氯酸的工艺流程如下:
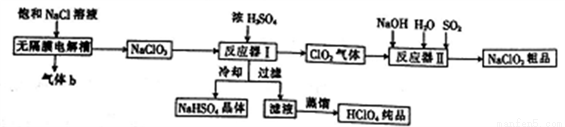
已知:NaHSO4的溶解度随温度的升高而增大,适当条件下可结晶析出。请回答下列问题:
(1)NaClO2中氯元素的化合价为_________;某饱和NaCl溶液中含有CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是________。
(2)气体b是______(填化学式);无隔膜电解槽中阳极的电极反应式为___________。
(3)反应器I中发生反应的化学方程式为_________,冷却的目的是___________。
(4)反应器II中发生反应的离子方程式为________________。
(5)常温下,HClO2的电离平衡常数Ka=1.07×10-2,反应器II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中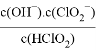 =__________。
=__________。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:选择题
某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同。为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验:
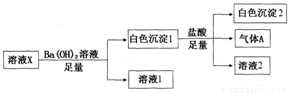
下列说法正确的是
A. 气体A可能是CO2或SO2
B. 溶液X中一定存在SO42-、HCO3-、Na+、Mg2+
C. 溶液X中一定不存在Fe3+和Mg2+,可能存在Na+
D. 分别在溶液1和溶液2中加入硝酸酸化的硝酸银溶液都能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 二氧化硫和氯气都能使品红溶液褪色
B. 漂白粉暴露在空气中久置会变质
C. 在加热条件下,镁能在二氧化碳气体中燃烧
D. 氯水中真正起漂白、杀菌、消毒作用的微粒是其中含有的Cl2分子
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:选择题
下列属于碱的是
A. Na2SO4 B. NaOH C. H2SO4 D. CO2
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省大庆市高三第二次教学质量检测(二模)理科综合化学试卷(解析版) 题型:选择题
下列选用的仪器和药品能达到实验目的的是
A | B | C | D |
|
|
|
|
制取NaHCO3 | 检验反应产生的SO2 | 蒸馏时的接收装置 | 制取NO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省四地六校高二下学期第一次联考(3月)化学试卷(解析版) 题型:推断题
下表是关于有机物A、B、C的信息:
A | B | C |
①它的产量可衡量一个国家石油化工发展水平; ②能使溴的四氯化碳溶液褪色; ③可用于果实催熟. | ①C、H两种元素组成 ②分子球棍模型为 | ①分子键线式为 ②相对分子质量为68 |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为_______________;
(2)A在一定条件下,与水反应制乙醇的化学方程式:____________________;反应类型是______。
(3)B具有的性质是_____________________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤任何条件下均不与氢气反应
⑥一定条件下,能与CH2=CH2反应制苯乙烷 ⑦与溴水混合后液体分层且上层呈橙红色
(4)写出B的最简单同系物制TNT的化学方程式 _____________________;反应类型是________。
(5)C是天然橡胶的单体,写出天然高分子橡胶的结构简式________________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省四地六校高一下学期第一次联考(3月)化学试卷(解析版) 题型:实验题
某同学在实验室研究Fe与H2SO4的反应
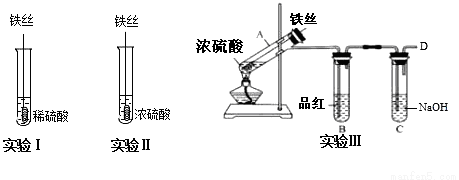
【实验分析】
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为__.
(2)实验Ⅱ中,铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止,
这一现象被称为__.
(3)实验Ⅲ,已知:浓H2SO4的沸点为338.2℃,加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体. A中产生的气体是__,装置C的作用是__.
(4)实验Ⅲ结束后,
甲同学认为装置C中产生Na2SO3,
乙同学认为SO2过量,产物中还可能含有_________,
丙同学认为可能还含有Na2SO4,设计简单实验验证是否含有SO42-,正确的是(____)
A.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在
B.先加入硝酸钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在
C.先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在
(5)对比实验Ⅰ、Ⅱ和Ⅲ,同学们得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性源于+6价的S元素,稀硫酸的氧化性源于________.
②影响反应产物多样性的因素有_____________________(至少填两个).
查看答案和解析>>
科目:高中化学 来源:2017届四川省高高三下学期二诊模拟理科综合化学试卷(解析版) 题型:选择题
下列有关物质的实验操作、现象及结论描述正确的是
选项 | 实验操作及现象 | 结论 |
A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃) | 待测试液中一定含有钾元素,可能含钠元素 |
B | 向某无色溶液中通入过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO32– |
C | 向品红溶液中通入某气体后,溶液褪色 | 该气体一定是SO2 |
D | 向NaOH溶液中滴加MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀 | Fe(OH)3的溶解度大于Mg(OH)2的溶解度 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com