
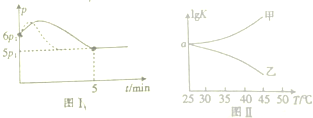
| △c |
| △t |
| 6 |
| 5 |
| 0.08+0.04 |
| 0.08+0.04-x |
| ||
| 5min |
| (0.08-2×0.02) |
| 2 |
| c2(NOCl) |
| c2(NO)c(Cl2) |
| 0.022 |
| 0.022×0.01 |


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
| A、过氧化钠和水反应:2Na2O2+2H2O=4Na++4OH-+O2↑ |
| B、用铜为电极电解饱和食盐水:2Cl-+2H2O=Cl2↑+H2↑+2OH- |
| C、在明矾溶液中滴加过量氨水:Al3++3OH-=Al(OH)3↓ |
| D、向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
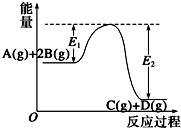
| A、该反应为吸热反应 |
| B、当反应达到平衡时,降低温度,A的转化率减小 |
| C、升高温度,平衡常数K增大;压强增大,平衡向正反应方向移动 |
| D、加入催化剂,反应速率增大,E1减小,E2减小,反应热不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
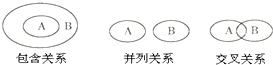
| A、非金属氧化物与酸性氧化物属于包含关系 |
| B、化合物与电解质属于包含关系 |
| C、单质与化合物属于交叉关系 |
| D、氧化还原反应与化合反应属于并列关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 气体 | 固体反应物 | 选用的酸 | 该酸的作用 | 离子方程式 |
| CO2 | 大理石 | |||
| Cl2 | MnO2 | |||
| H2 | 锌粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
| CO(NH2)2?H2O2 | 白色晶体 | 45℃ | 75-85℃ | 500g?L-1 |
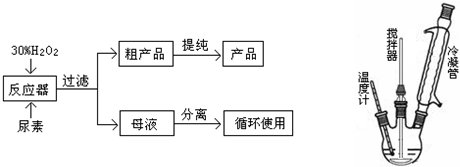
查看答案和解析>>
科目:高中化学 来源: 题型:
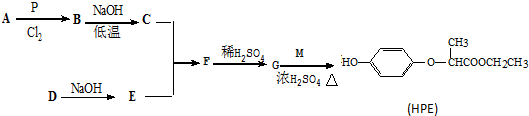
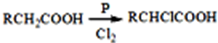
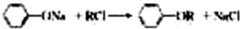
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制NO时,将鼻孔凑到集气瓶口闻NO的气味 |
| B、在气体发生装置上直接点燃氢气时,必须先检验氢气的纯度 |
| C、实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 |
| D、给试管中的固体加热时直接固定加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com