
科目:高中化学 来源: 题型:阅读理解
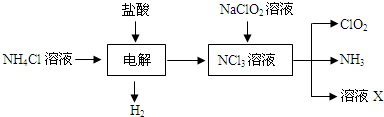
| 实验步骤 | 实验现象 | 实验结论 |
| ① 取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 |
火焰呈黄色 火焰呈黄色 |
溶液X中含有钠离子 |
| ② 取少许溶液X于一支试管中,先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液) 取少许溶液X于一支试管中,先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液) |
产生白色沉淀 产生白色沉淀 |
溶液X中含有氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| △ |
| ||
| △ |
| ||||
|
| ||||
|
查看答案和解析>>
科目:高中化学 来源:2012届上海交通大学附属中学高二第二学期期末化学试卷 题型:实验题
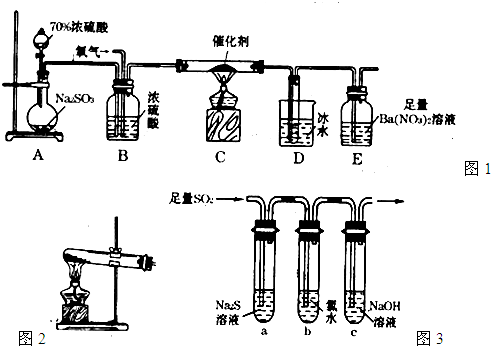
有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某同学设计了如图装置(夹持装置仪器已省略),其实验操作为:按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻。然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
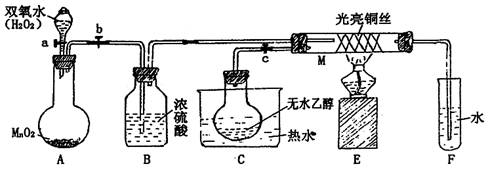
(1) A中发生反应的化学方程式: ,
B的作用: ;C中热水的作用: 。
(2) M处发生反应的化学方程式为: 。
(3) M管中可观察到的现象: ,从中可认识到该实验过程中催化剂 (填“参加”或“不参加”)化学反应,还可以认识到催化剂起催化作用需要一定的 。
(4) 验证乙醇氧化产物的试剂是 ,并写出对应的化学方程式 。
(5) 若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有 ,要除去该物质,可先在混合液中加入 (填写字母)。
a、氯化钠溶液 b、苯 c、碳酸氢钠溶液 d、四氯化碳
查看答案和解析>>
科目:高中化学 来源:湖南省月考题 题型:实验题
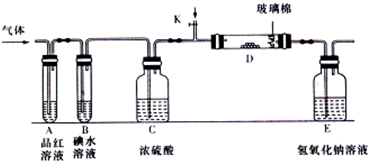
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
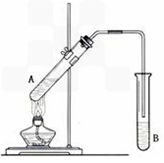
(A)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
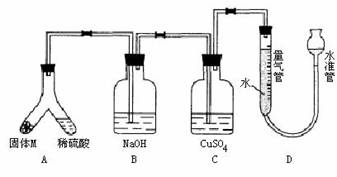
由上述实验事实可知:
(1)①固体M中一定有的物质是______________(填化学式) 理由是_______________
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是________。
写出B装置中反应的离子方程式_______________________________________。
(3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是_________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
a.M中有未反应的铁和硫 b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体 d.气体进入D装置前未用浓硫酸干燥
(B)某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
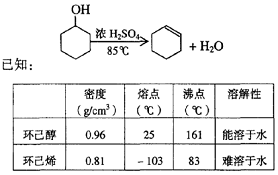
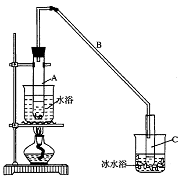
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是________________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
a.蒸馏时从70℃开始收集产品 b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com