
分析 依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;依据浓硫酸稀释的正确操作、配制一定物质的量浓度的溶液的正确方法解答.
解答 解:①设需要浓硫酸体积为V,溶液稀释过程中溶质的物质的量不变,则18.0mol•L-1×V=1.80mol•L-1×100ML,解得V=10.0ml,
故答案为:10.0;
②浓硫酸稀释的方法为:将浓硫酸沿着烧杯内壁慢慢注入盛有少量蒸馏水的烧杯中,同时用玻璃棒不断搅拌,
故答案为:浓硫酸;水;
③要配制稀硫酸100mL,应选择100ml容量瓶,
故答案为:100;
⑤定容时向容量瓶中加蒸馏水,直至液面接近刻度线1-2cm,改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切;
故答案为:1-2cm;胶头滴管.
点评 本题考查了配制一定物质的量浓度的溶液方法及误差分析,熟悉配制原理和步骤是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 任何酸与碱发生中和反应生成1mol H2O的过程中,能量变化均相同 | |
| B. | 已知:C (s,石墨)=C (s,金刚石)△H=+1.5 kJ•mol-1,则金刚石比石墨更稳定 | |
| C. | 若①2H2 (g)+O2 (g)=2H2O (g)△H=-a kJ•mol-1,②2H2 (g)+O2 (g)=2H2O (l)△H=-b kJ•mol-1,则 b>a | |
| D. | 能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaF>NaCl>NaBr>NaI | B. | Na20>Na2S>NaCl>NaI | ||
| C. | NaCl>CaCl2>MgCl2>AlCl3 | D. | MgCO3>CaCO3>SrCO3>BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
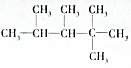 的烷烃,则此烯烃可能的结构简式是CH2=CHCH3CHCH3C(CH3)3、(CH3)2C=CCH3C(CH3)3、(CH3)2CHC=CH2C(CH3)3.
的烷烃,则此烯烃可能的结构简式是CH2=CHCH3CHCH3C(CH3)3、(CH3)2C=CCH3C(CH3)3、(CH3)2CHC=CH2C(CH3)3.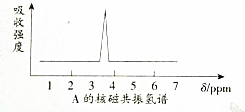
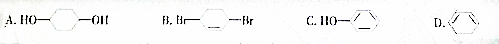
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )
用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )| A. | 选用酚酞作指示剂的滴定终点的判断:当浅红色变为无色且半分钟内仍为无色时即为滴定终点 | |
| B. | 滴定终点读数时,俯视滴定管的刻度(其他操作均正确),会造成测定结果偏低 | |
| C. | 甲滴定管中盛有H2SO4溶液,液面恰好在10.00mL刻度处,并把甲滴定管中的H2SO4溶液全部放入烧杯中,其体积为40.00mL | |
| D. | 量取15.00mLKMnO4溶液应选择乙滴定管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
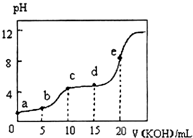 常温下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1某二元弱酸H2R溶液,所得滴定曲线如图所示.下列叙述正确的是( )
常温下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1某二元弱酸H2R溶液,所得滴定曲线如图所示.下列叙述正确的是( )| A. | a点所示溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$<1012 | |
| B. | c点所示溶液中:c(K+)>c(HR-)>c(H2R)>c(R2-) | |
| C. | e点所示溶液中:c(H+)=c(HR-)+2c(H2R)+c(OH-) | |
| D. | 五个点中d点时c(HR-)最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | H2SO3 | HSO3- | H2CO3 | HCO3- |
| PKa | 1.9 | 7.2 | 6.4 | 10.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后盐水解使溶液呈碱性 | B. | 弱酸溶液和强碱溶液反应 | ||
| C. | 强酸溶液和弱碱溶液反应 | D. | 一元强酸溶液和一元强碱溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com