
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2LNO2完全溶于水,转移电子数为0.5NA
B.20gD2O和HTO两种水的组合中含有的中子数为10NA
C.一定温度下,1molH2和足量碘蒸气反应产生的H-I键数目为2NA
D.标准状况下,22.4L的HF中含有的原子数目为2NA
【答案】B
【解析】
A. 标准状况下,11.2LNO2的物质的量为0.5mol,二氧化氮与水的反应为3NO2+H2O=2HNO3+NO,3mol NO2反应转移2mol电子,0.5mol NO2反应转移![]() mol电子,转移电子数为
mol电子,转移电子数为![]() NA,A错误;
NA,A错误;
B. D2O和HTO的摩尔质量都为20g/mol,20gD2O和HTO两种水的组合物质的量为1mol,1个D2O和HTO中都含有10个中子,则含有的中子数为10NA,B正确;
C. H2和碘蒸气的反应是可逆反应,1molH2和足量碘蒸气反应产生的H-I键数目小于2NA,C错误;
D. 标准状况下,HF不是气体,不能使用标况下的气体摩尔体积计算HF的物质的量,D错误;答案选B。


科目:高中化学 来源: 题型:
【题目】冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在200℃和10MPa的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4和CH3OH的燃烧热分别784kJ/mol和628kJ/mol则2CH4(g)+O2(g)=2CH3OH(g) △H=___。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)CH3OCH3(g) +H2O(g) △H<0。
①某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是____。
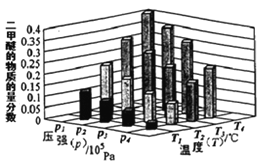
A.P3>P2,T3>T2
B.P1>P3,T1>T3
C.P1>P4,T2>T3
D.P2>P4,T4>T2
②在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___。
A.氢气的转化率减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g) +N2(g)
2CO2(g) +N2(g)
①200K、pPa时,在一个容积为2L的恒温密闭容器中充入1.5molNO和2.0molCO,开始反应至2min时测得CO转化率为30%,则用N2表示的平均反应速率为υ(N2)=___;反应达到平衡状态时,测得二氧化碳为0.8mol,则平衡时的压强为起始压强的__倍(保留两位小数)。
②该反应在低温下能自发进行,该反应的ΔH__0(填“>”、“<”)
③在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2-t1=t3-t2)则下列说法不正确的是__(填编号)
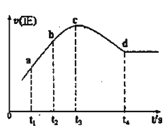
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:t1~t2 > t2~t3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是
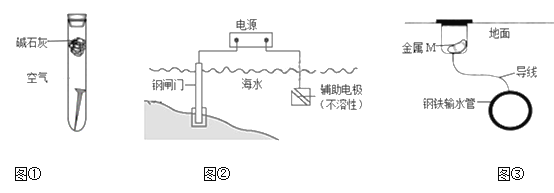
A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
C. 图②,若断开电源,钢闸门将发生吸氧腐蚀
D. 图③,若金属M比Fe活泼,可防止输水管腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.92g铜粉与一定量的浓硝酸反应,当铜粉完全作用时收集到气体1.12L(标准状况下),则消耗硝酸的物质的量是
A.0.12molB.0.09molC.0.11molD.0.08mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制HNO3的过程中排放的NO2和NO常用NaOH溶液吸收,反应的化学方程式为NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O,NO不能被NaOH溶液吸收。若同温同压下NO2与NO的体积之比如下,其中不能被NaOH溶液完全吸收的是( )
A.1:1B.1:3C.2:1D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解池原理进行实验探究。
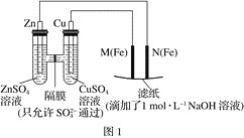
请回答:
Ⅰ.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是____(填序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应为___。
(3)实验过程中,SO42-___(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有___。
Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
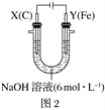
(4)电解过程中,X极区溶液的pH___(填“增大”、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O、___。
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况下的气体体积),则Y电极(铁电极)质量减少___g。
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20g/3。
⑴此浓盐酸的物质的量浓度是多少?_______________(列式计算)
⑵配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL? ______________(列式计算)
⑶用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号):_____________________ 。
①计算②装瓶③用50mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物0.3克完全燃烧后生成224毫升(标准状况)二氧化碳和0.18克水。已知该物质的蒸气对氢气的相对密度为30,试求:
(1)有机物的分子式___________
(2)试写出该有机物可能的结构简式并命名____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图所示。下列说法不正确的是
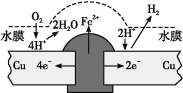
A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C.铜极上的反应是2H++2e =H2↑、O2+4e+4H+=2H2O
D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com