
 ŌŚĪĀ¶ČT1ŗĶT2ĻĀ£¬X2£Øg£©ŗĶH2£Øg£©·“Ӧɜ³ÉHX£Øg£©µÄĘ½ŗā³£ŹżKČēĻĀ±ķ£ŗ
ŌŚĪĀ¶ČT1ŗĶT2ĻĀ£¬X2£Øg£©ŗĶH2£Øg£©·“Ӧɜ³ÉHX£Øg£©µÄĘ½ŗā³£ŹżKČēĻĀ±ķ£ŗ| »Æѧ·½³ĢŹ½ | K£Øt1£© | K£Øt2£© |
| F2+H2?2HF | 1.8”Į1036 | 1.9”Į1032 |
| Cl2+H2?2HCl | 9.7”Į1012 | 4.2”Į1011 |
| Br2+H2?2HBr | 5.6”Į107 | 9.3”Į106 |
| I2+H2?2HI | 43 | 34 |
·ÖĪö £Ø1£©KÖµŌ½“ó£¬ĖµĆ÷·“Ó¦µÄÕżĻņ³Ģ¶ČŌ½“󣬼“×Ŗ»ÆĀŹŌ½øߣ¬·“Ó¦µÄÕżĻņ³Ģ¶ČŌ½Š”£¬ĖµĆ÷Éś³ÉĪļŌ½²»ĪČ¶Ø£¬Ō½Ņ×·Ö½ā£»
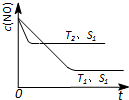
£Ø2£©¢ŁĪĀ¶ČĪŖT1Ź±£¬ŌŚ0”«tAminÄŚ£¬”÷n£ØHI£©=nA mol£¬v£ØHI£©=$\frac{{n}_{A}mol}{3L”Į{t}_{A}min}$£¬$\frac{v£Ø{H}_{2}£©}{v£ØHI£©}=\frac{1}{2}$£»
¢ŚĻČ¹ÕĻČĘ½ŹżÖµ“ó£¬T2£¾T1£¬ÉżøßĪĀ¶Č£¬HIµÄĪļÖŹµÄĮæ¼õŠ”£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬ŌņÕż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬K¼õŠ”£¬ĘųĢåµÄ×ÜÖŹĮæ²»±ä£¬Ģå»żĪŖ3L£¬Ņņ“ĖĆܶȏĒŅ»øö¶ØÖµ£»
£Ø3£©øł¾ŻHFŹōÓŚČõµē½āÖŹ£¬ŌņŌŚ¼ÓĖ®²»¶ĻĻ”ŹĶŹ±£¬µēĄė³Ģ¶ČŌö“󣬵ēĄėĘ½ŗā±£³ÖĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬²¢×¢ŅāĪĀ¶Č²»±äŹ±£¬µēĄėĘ½ŗā³£Źż²»±äĄ“½ā“š£»
£Ø4£©AgClŠü×ĒŅŗÖŠ“ęŌŚ³ĮµķČܽāĘ½ŗā£ŗAgCl£Øs£©?Ag+£Øaq£©+Cl-£Øaq£©£¬¼ÓČėµāĄė×Ó£¬Ę½ŗāÕżŅĘ£¬ĀČ»ÆŅų×Ŗ»ÆĪŖµā»ÆŅų£®
½ā“š ½ā£ŗ£Ø1£©KÖµŌ½“ó£¬ĖµĆ÷·“Ó¦µÄÕżĻņ³Ģ¶ČŌ½“󣬼“×Ŗ»ÆĀŹŌ½øߣ¬dÕżČ·£»·“Ó¦µÄÕżĻņ³Ģ¶ČŌ½Š”£¬ĖµĆ÷Éś³ÉĪļŌ½²»ĪČ¶Ø£¬Ō½Ņ×·Ö½ā£¬Ņņ“ĖŃ”ĻīcÕżČ·£»¶ųŃ”Ļīa”¢bÓėKµÄ“óŠ”ĪŽÖ±½ÓĮŖĻµ£¬
¹Ź“š°øĪŖ£ŗcd£»
£Ø2£©¢ŁĪĀ¶ČĪŖT1Ź±£¬ŌŚ0”«tAminÄŚ£¬”÷n£ØHI£©=nA mol£¬v£ØHI£©=$\frac{{n}_{A}mol}{3L”Į{t}_{A}min}$=$\frac{{n}_{A}}{3{t}_{A}}$mol/£ØL•min£©£¬
ÓÉ$\frac{v£Ø{H}_{2}£©}{v£ØHI£©}=\frac{1}{2}$æɵĆv£ØH2£©=$\frac{1}{2}”Į$$\frac{{n}_{A}}{3{t}_{A}}$mol/£ØL•min£©=$\frac{{n}_{A}}{6{t}_{A}}$mol/£ØL•min£©£¬
¹Ź“š°øĪŖ£ŗ$\frac{{n}_{A}}{6{t}_{A}}$mol/£ØL•min£©£»
¢ŚĻČ¹ÕĻČĘ½ŹżÖµ“ó£¬T2£¾T1£¬ÉżøßĪĀ¶Č£¬HIµÄĪļÖŹµÄĮæ¼õŠ”£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬ŌņÕż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬K¼õŠ”£¬ÓÉÓŚĘųĢåµÄ×ÜÖŹĮæ²»±ä£¬Ģå»żĪŖ3L£¬Ņņ“ĖĆܶȏĒŅ»øö¶ØÖµ£¬
¹Ź“š°øĪŖ£ŗa”¢b£»
£Ø3£©A”¢ŅņHFĪŖČõĖį£¬ŌņÅضČĪŖ0.1mol•L-1HFČÜŅŗ¼ÓĖ®²»¶ĻĻ”ŹĶ£¬“Ł½ųµēĄė£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬µēĄė³Ģ¶ČŌö“ó£¬n£ØH+£©Ōö“󣬵«c£ØH+£©²»¶Ļ¼õŠ”£¬¹ŹA“ķĪó£»
B”¢ŅņµēĄėĘ½ŗā³£ŹżÖ»ÓėĪĀ¶ČÓŠ¹Ų£¬ŌņKa£ØHF£©ŌŚĻ”ŹĶ¹ż³ĢÖŠ²»±ä£¬¹ŹB“ķĪó£»
C”¢ŅņĻ”ŹĶŹ±Ņ»¶ĪŹ±¼äµēĄė²śÉśµČĮæµÄH+ŗĶF-£¬ČÜŅŗµÄĢå»żĻąĶ¬£¬ŌņĮ½ÖÖĄė×ÓµÄÅØ¶ČµÄ±ČÖµ²»±ä£¬µ«Ėę×ÅĻ”ŹĶµÄ²»¶Ļ½ųŠŠ£¬c£ØH+£©²»»į³¬¹ż10-7mol•L-1£¬c£ØF-£©²»¶Ļ¼õŠ”£¬Ōņ±ČÖµ±äŠ”£¬¹ŹC“ķĪó£»
D”¢ŅņKa£ØHF£©=$\frac{c£Ø{F}^{-}£©”Įc£Ø{H}^{+}£©}{c£ØHF£©}$£¬µ±HFČÜŅŗ¼ÓĖ®²»¶ĻĻ”ŹĶ£¬“Ł½ųµēĄė£¬c£ØF-£©²»¶Ļ¼õŠ”£¬Ka£ØHF£©²»±ä£¬Ōņ$\frac{c£Ø{H}^{+}£©}{c£ØHF£©}$Ōö“󣬹ŹDÕżČ·£»
¹Ź“š°øĪŖ£ŗD£»
£Ø4£©ŅŃÖŖAgClŠü×ĒŅŗÖŠ“ęŌŚ³ĮµķČܽāĘ½ŗā£ŗAgCl£Øs£©?Ag+£Øaq£©+Cl-£Øaq£©£»ĻņŹ¢ÓŠ10mL 0.1mol•L-1 AgNO3ČÜŅŗµÄŹŌ¹ÜÖŠµĪ¼Ó0.1mol•L NaClČÜŅŗ£¬ÓŠAgCl°×É«³ĮµķÉś³É£¬ÓÉÓŚAgIČܽā¶Č±ČAgClČܽā¶ČŠ”£¬I-ÓėAg+½įŗĻ£¬Ź¹Ę½ŗāĢåĻµÖŠc£ØAg+£©¼õŠ”£¬Ź¹Ę½ŗāĻņÓŅŅĘ¶Æ£¬
¹Ź“š°øĪŖ£ŗAgIČܽā¶Č±ČAgClČܽā¶ČŠ”£¬Ź¹AgCl£Øs£©?Ag+£Øaq£©+Cl-£Øaq£©ĢåĻµÖŠc£ØAg+£©¼õŠ”£¬Ź¹Ę½ŗāĻņÓŅŅĘ¶Æ£®
µćĘĄ ±¾Ģāæ¼²éÖŖŹ¶µć½Ļ¶ą£¬Éę¼°»Æѧ·“Ó¦ĖŁĀŹµÄ¼ĘĖć”¢»ÆŃ§Ę½ŗāµÄÓ°ĻģŅņĖŲ”¢Čõµē½āÖŹµÄµēĄė”¢³ĮµķČܽāĘ½ŗāµČÖŖŹ¶µć£¬ÄѶČÖŠµČ£¬ĪŖøßĘµæ¼µć£¬ÕĘĪÕÓŠ¹ŲĖÄ“óĘ½ŗāµÄ»Æѧ·“Ó¦ŌĄķŹĒ“šĢā¹Ų¼ü£®


 °ŁÄźŃ§µäæĪŹ±Ń§Į·²āĻµĮŠ“š°ø
°ŁÄźŃ§µäæĪŹ±Ń§Į·²āĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĖįŠŌČÜŅŗÖŠ£ŗAl3+”¢Fe3+”¢SO42-”¢SCN- | |
| B£® | ĶøĆ÷ČÜŅŗÖŠ£ŗMnO4-”¢K+”¢Na+”¢NO3- | |
| C£® | Ēæ¼īŠŌČÜŅŗÖŠ£ŗNa+”¢NO3-”¢HCO3-”¢SO32- | |
| D£® | ĒæĖįŠŌČÜŅŗÖŠ£ŗNa+”¢Fe2+”¢SO42-”¢NO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
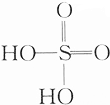 £© ¢ŪC2H5OH ¢ÜCH3COOH£®
£© ¢ŪC2H5OH ¢ÜCH3COOH£®| A£® | ¢Ł£¾¢Ś£¾¢Ū£¾¢Ü | B£® | ¢Ś£¾¢Ū£¾¢Ü£¾¢Ł | C£® | ¢Ś£¾¢Ü£¾¢Ł£¾¢Ū | D£® | ¢Ü£¾¢Ū£¾¢Ś£¾¢Ł |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | a£¼0 | |
| B£® | Ź¹ÓĆ“ß»Æ¼ĮÄܼÓæģ·“Ó¦ĖŁĀŹ²¢Ģįøß·“Ó¦ĪļµÄĘ½ŗā×Ŗ»ÆĀŹ | |
| C£® | ½µµĶĪĀ¶Č£¬COµÄĘ½ŗā×Ŗ»ÆĀŹ½µµĶ | |
| D£® | ½µµĶĪĀ¶Č£¬ø÷ĪļÖŹµÄÅØ¶Č²»±ä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
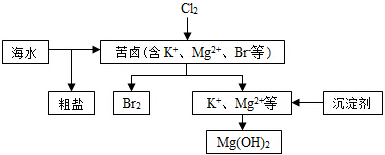
| A£® | ĻņæąĀ±ÖŠĶØČėCl2£¬ÄæµÄŹĒĪŖĮĖĢįČ”äå | |
| B£® | ³żČ„“ÖŃĪÖŠµÄSO42-ŌÓÖŹ£¬æÉŅŌŃ”ŌńBaCl2µČŹŌ¼Į | |
| C£® | ¹¤ŅµÉś²ś³£Ń”ÓĆCa£ØOH£©2×÷ĪŖ³Įµķ¼Į | |
| D£® | µē½ā·ØÖĘČ”½šŹōĆ¾Ź±£¬ŌĮĻŅ»°ćŹĒ×ĘÉÕMg £ØOH£©2µĆµ½µÄMgO |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ź¹ŠĀĻŹµÄŗģƵ¹å»ØĶŹÉ«£ØHCl£© | B£® | ŠĀÖĘĀČĖ®³ŹĒ³»ĘĀĢÉ«£ØCl2£© | ||
| C£® | ¼ÓČėŠ”ĖÕ“ņ¹ĢĢ壬ӊĘųÅŻ²śÉś£ØH+£© | D£® | µĪ¼ÓAgNO3ČÜŅŗÉś³É°×É«³Įµķ£ØCl-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | “ĪĀČĖįøʵĻÆѧŹ½£ŗCaClO | |
| B£® | ·śĄė×Ó½į¹¹Ź¾ŅāĶ¼£ŗ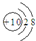 | |
| C£® | ÖŹĮæŹżĪŖ127µÄ±µŌ×Ó£ŗ127Ba | |
| D£® | ĮņĖįµÄµēĄė·½³ĢŹ½£ŗH2SO4ØT2H+SO${\;}_{4}^{2-}$ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ʤ·ōÉĻÕ“ĮĖÉŁĮæ±½·Ó£¬ĻČÓĆĻ”NaOHČÜŅŗĻ“£¬ŌŁÓĆĖ®³åĻ“ | |
| B£® | ×öĶźŅų¾µ·“Ó¦µÄŹŌ¹Ü£¬Ó¦øĆÓĆĻ”ĮņĖįĒåĻ“ | |
| C£® | ŹŌ¹ÜÖŠ²ŠĮōµÄ±½·Ó£¬ĻČÓĆĻ”NaOHČÜŅŗĻ“£¬ŌŁÓĆĖ®³åĻ“ | |
| D£® | Õ³ÓŠ·ÓČ©Ź÷Ö¬µÄŹŌ¹Ü£¬æÉĻČÓĆĖ®½žÅŻ¼ø·ÖÖÓ£¬Čķ»Æ£¬ŌŁĒåĻ“ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £Ø1£©ŅŃÖŖŌŚ³£ĪĀ³£Ń¹ĻĀ£ŗ
£Ø1£©ŅŃÖŖŌŚ³£ĪĀ³£Ń¹ĻĀ£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com