
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生 的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ/mol(反应I)
CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H2=-175.6kJmol-l(反应II)
CaS(s)+4CO2(g) △H2=-175.6kJmol-l(反应II)
请冋答下列问题:
(1)反应I能够自发进行的条件是____________。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应II的Kp="___________" (用表达式表示)。
(3)假设某温度下,反应I的速率(v1)大于反应II的速率(v2),则下列反应过程能量变化示意图正确的是______________。

(4)通过监测反应体系中气体浓度的变化判断反应I和II是否同时发生,理由是___________。
(5)图I为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有__________。
A.向该反应体系中投入石灰石 B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数 D.提高反应体系的温度
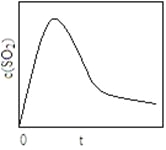
(6)恒温恒容条件下,假设反应I和II同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)
随时间t变化的总趋势图。

【答案】(1)较高温度下 (2)P4(CO2)/P4(CO)(3)C (4)有无二氧化硫可知反应I是否发生,如c(CO2)=c(SO2),则反应II未发生,如c(CO2)>c(SO2),则反应同时发生 (5)ABC
(6)
【解析】试题分析:(1)反应Ⅰ吸热,则△H>0,由方程式可知△S>0,反应能自发进行,应满足△G=△H-T△S<0,因此应在较高温度下进行,即选择高温。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则根据反应的化学方程式可知,反应Ⅱ的Kp=P4(CO2)/P4(CO)。
(3)反应Ⅰ为吸热反应,产物的能量高于反应物,反应Ⅱ为放热反应,产物的能量低于反应物,则A、D错误;由方程式可知反应Ⅱ气体较多,则活化能较大,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则B错误、C正确,答案选C。
(4)反应Ⅰ生成SO2,反应Ⅱ只生成CO2,如同时发生,则两种气体的浓度比变化,据此可以确定是否发生两个反应。即如c(CO2)=c(SO2),则反应II未发生,如c(CO2)>c(SO2),则反应同时发生。
(5)A、向该反应体系中投入石灰石,产生CO2,使反应I逆向进行,可使更多的二氧化硫转化为硫酸钙,减少二氧化硫的排放,A正确;B、由反应Ⅰ可知生成二氧化硫的反应为吸热反应,则低温下不利于生成二氧化硫,图中可以看出温度最低时的CaS的含量最高,则应在合适的温度区间内控制较低的反应温度,B正确;C、由图像可知,提高CO的初始体积百分数,可以增大CaS的质量分数,减少二氧化硫的排放,C正确;D、提高反应体系的温度,不利于二氧化硫的减少,D错误,答案选ABC。
(6)反应Ⅰ和Ⅱ同时发生,且反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),故SO2增加的快,反应达到平衡的快;随着反应II的进行,CO2的浓度不断增大,使反应I平衡逆向移动,SO2浓度又逐渐降低。则图像应为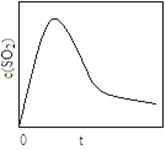 。
。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质应用的说法正确的是
A. 铝罐可久盛食醋 B. 盐类都可用作调味品
C. 生石灰用作食品抗氧化剂 D. 小苏打是面包发酵粉的主要成分之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有化学药品:锌、稀硝酸、浓硫酸、盐酸、苛性钠、生石灰、纯碱。能与锌、纯碱保存在同一药橱中的是( )
A.稀硝酸、浓硫酸、盐酸 B.生石灰、稀硝酸
C.苛性钠、生石灰 D.稀硝酸、浓硫酸、盐酸、苛性钠、生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是

A.维持温度、容积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度、容积不变,t1时充入一定量Ar
D.维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)19g某金属氯化物ACl2中含有0.4molCl-离子,则ACl2的摩尔质量是____________, A的相对原子质量是___________。
(2)同温同压下,质量相同的五种气体:①CO2②H2③O2④CH4⑤SO2,所占体积由大到小的顺序是(填序号,下同) ; 密度由大到小的顺序是 。
(3)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体的平均摩尔质量为 。
(4)VmLAl2(SO4)3溶液中含Al3+ ag,取V/4mL溶液稀释到VmL,则稀释后溶液中SO42-的物质的量浓度是 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列说法正确的是
A. 34S原子核内中子数为16 B. 16O2比18O2沸点更低
C. 2H+的酸性比1H+的酸性更强 D. 13C和15N原子核内的质子数相差2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.物质的溶解性为难溶,则该物质不溶于水
B.不溶于水的物质溶解度为0
C.绝对不溶解的物质是不存在的
D.某离子被沉淀完全是指该离子在溶液中的浓度为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 增大压强,使单位体积内活化分子数目增加,化学反应速率一定增大
B. 升高温度,使活化分子百分数增加,化学反应速率一定增大
C. 活化分子间所发生的分子间的碰撞均为有效碰撞
D. 加入反应物,使活化分子百分数增加,化学反应速率一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com