
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
B.含NA个Na+的Na2O溶解于1L水中,所得溶液中Na+的物质的量浓度为1mol·L-1
C.在 反应中,每生成32g氧气,则转移2NA个电子
反应中,每生成32g氧气,则转移2NA个电子
D.常温下,1L0.50mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液所含![]() 物质的量相同
物质的量相同
【答案】C
【解析】
A.n(H2SO4)=18.4mol·L-1×50mL×10-3=0.92mol,假设H2SO4完全反应,则由![]() 可知,生成SO2的物质的量=
可知,生成SO2的物质的量=![]() =0.46mol,即生成SO2分子的数目为0.46NA,但是,随着反应的进行,H2SO4的浓度降低变为稀硫酸,稀硫酸不能发生上述反应,故生成SO2分子的数目小于0.46NA,A错误;
=0.46mol,即生成SO2分子的数目为0.46NA,但是,随着反应的进行,H2SO4的浓度降低变为稀硫酸,稀硫酸不能发生上述反应,故生成SO2分子的数目小于0.46NA,A错误;
B.Na2O+H2O=2NaOH,所得溶液中,n(Na+)=1mol,溶液体积未知,不能计算Na+的物质的量浓度,B错误;
C.由![]() 可知,每生成1molO2转移2mol电子,即每生成32g氧气,则转移2NA个电子,C正确;
可知,每生成1molO2转移2mol电子,即每生成32g氧气,则转移2NA个电子,C正确;
D.1L0.50mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液的n(NH4Cl)相等,但是二者浓度不同,NH4+水解程度不同,故二者所含![]() 物质的量不相同,D错误。
物质的量不相同,D错误。
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是( )

A.电池放电时Na+从b极区移向a极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.每消耗1molH2O2,转移的电子为1mol
D.该电池的正极反应为:BH4-+8OH--8e-=BO2-+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 1L水中溶解了40.0 g NaOH,该溶液的物质的量浓度为1 mol/L
B. 从1L2mol/L的NaCl液中取出0.5L,取出的该溶液的浓度为1mol/L
C. 中和100 mL 1mol/L的H2SO4溶液,需NaOH8.0g
D. 配制500mL0.5mol/L的CuSO4溶液,需40.0g胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.离子半径(r):![]()
B.若存在简单阴离子![]() ,则X一定属于第ⅦA族元素
,则X一定属于第ⅦA族元素
C.S和Se属于第ⅥA族元素,H2S的还原性比H2Se的弱
D.元素周期表中从第ⅢB族到第ⅡB族10个纵行的元素都是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:_____________。装置B中饱和食盐水的作用是_____________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 _____________________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。(填字母序号)
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为__________色,说明_________________________。
打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 _______________,写出反应的化学方程式是_________________________。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是
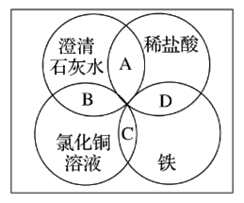
A. 复分解反应、复分解反应、化合反应、置换反应
B. 中和反应、置换反应、复分解反应、置换反应
C. 复分解反应、复分解反应、置换反应、置换反应
D. 分解反应、复分解反应、置换反应、置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置及操作均正确的是

A. 图I中A盛放碳酸氢钠,B盛放碳酸钠,可对比二者的热稳定性
B. 图II可用于从NaCl溶液中提取NaCl晶体
C. 图III为实验室制备氨气的实验药品与发生装置
D. 图IV为实验室制备观察氢氧化亚铁的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g) ②2HI(g)
NH3(g)+HI(g) ②2HI(g)![]() H2(g)+I2(g) 达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,,则此温度下反应①的平衡常数为
H2(g)+I2(g) 达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,,则此温度下反应①的平衡常数为
A. 9 B. 16 C. 20 D. 25
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com