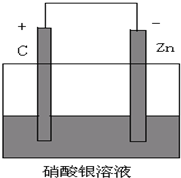
(1)选择适宜的材料和试剂设计一个原电池,完成下列反应:Zn+CuSO4=ZnSO4+Cu
①画出装置图:
②电极材料和电解质溶液各是什么?
③写出电极反应式:正极: ;负极: .
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气 L(标准状况下).导线中通过 mol电子.
【答案】
分析:(1)在原电池反应Zn+CuSO
4=ZnSO
4+Cu中,Zn为负极,发生氧化反应,较不活泼的金属如铜或碳棒作正极,发生还原反应;
(2)根据原电池正负极得失电子数目相等计算.
解答:解:(1)在原电池反应Zn+CuSO
4=ZnSO
4+Cu中,Zn为负极,发生氧化反应,电极反应为:Zn-2e
-=Zn
2+,较不活泼的金属如铜或碳棒作正极,发生还原反应,电极反应为:Cu
2++2e
-=Cu,电解质溶液为CuSO
4,如用两个半电池的话,电解质溶液分别为
ZnSO
4、CuSO
4,可设计原电池为
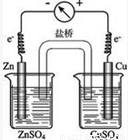
,
故答案为:①
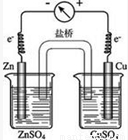
;
②负极为Zn,正极为Cu,电解质溶液分别为ZnSO
4、CuSO
4;
③正极反应为:Cu
2++2e
-=Cu;负极反应为:Zn-2e
-=Zn
2+;
(2)用锌片、铜片连接后浸入稀硫酸溶液构成的原电池中,负极:Zn-2e
-=Zn
2+;正极:2H
++2e
-=H
2↑,
n(H
2)=n(Zn)=
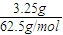
=0.05mol,
V(H
2)=0.05mol×22.4L/mol=1.12L,
n(e
-)=2n(Zn)=2×0.05mol=0.1mol,
故答案为:1.12;0.1.
点评:本题考查原电池的设计,题目难度不大,注意原电池的组成特点和工作原理.

 ,
, ;
;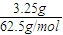 =0.05mol,
=0.05mol,