
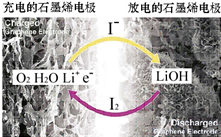
 科学家开发出一种新型锂-氧电池,其能量密度极高,效率达到90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH对于该电池的下列说法不正确的是( )
科学家开发出一种新型锂-氧电池,其能量密度极高,效率达到90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH对于该电池的下列说法不正确的是( )| A. | 充电时阴极反应为LiOH+e-═Li+OH | |
| B. | 充电时Li+从阳极区移向阴极区 | |
| C. | 放电时正极反应为O2+2H2O+4Li++4e-═4LiOH | |
| D. | 放电时负极上I- 被氧化 |
分析 A、充电时阴极发生得电子的还原反应;
B、充电时,电解质里的阳离子移向阴极,阴离子移向阳极;
C、放电时,正极上发生得电子的还原反应,据此书写电极反应式;
D、放电时,负极上发生失电子的氧化反应,元素的化合价升高;
解答 解:A、充电时阴极发生得电子的还原反应,应该是碘单质得电子的还原反应,故A错误;
B、充电时,电解质里的阳离子移向阴极,故B正确;
C、放电时,正极上发生得电子的还原反应,正极反应为O2+2H2O+4Li++4e-═4LiOH,故C正确;
D、放电时,负极上发生失电子的氧化反应,元素的化合价升高,根据总反应,得到I- 被氧化,故D正确;
故选A.
点评 本题以新型电池为载体考查原电池和电解池原理,明确原电池和电解池电极上得失电子即可解答,注意电极方程式的书写是关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3$→_{催化剂△}^{O_{2}}$NO$→_{H_{2}O}^{O_{2}}$HNO3 | |
| B. | 浓HCl$→_{△}^{MnO_{2}}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| C. | Al2O3$\stackrel{HCl(aq)}{→}$AlCl3(aq)$\stackrel{△}{→}$无水AlCl3$\stackrel{电解}{→}$Al | |
| D. | 淀粉$→_{△}^{H_{2}SO_{4}(aq)}$葡萄糖$\stackrel{酒化酶}{→}$C2H5OH$→_{Ag,△}^{O_{2}}$CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
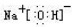 (写电子式,下同),既含有非极性共价键又含有离子键的化合物为
(写电子式,下同),既含有非极性共价键又含有离子键的化合物为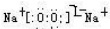 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Cl-<Mg2+<Na+ | B. | 非金属性:Si<C<N | ||
| C. | 碱性:Mg(OH)2<NaOH<KOH | D. | 稳定性:PH3<NH3<H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其最简单气态氢化物的稳定性小于(填“大于”或“小于”)NH3.
,其最简单气态氢化物的稳定性小于(填“大于”或“小于”)NH3.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.2mol•L-1•min-1 | B. | v(NO2)=0.2mol•L-1•min-1 | ||
| C. | v(H2O)=0.005mol•L-1•s-1 | D. | v(N2)=0.005mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com