
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,工业上生产亚氯酸钠和高氯酸的工艺流程如下:
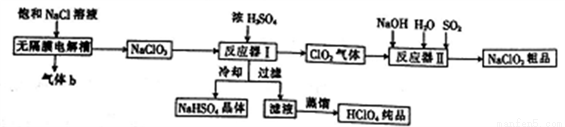
已知:NaHSO4的溶解度随温度的升高而增大,适当条件下可结晶析出。请回答下列问题:
(1)NaClO2中氯元素的化合价为_________;某饱和NaCl溶液中含有CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是________。
(2)气体b是______(填化学式);无隔膜电解槽中阳极的电极反应式为___________。
(3)反应器I中发生反应的化学方程式为_________,冷却的目的是___________。
(4)反应器II中发生反应的离子方程式为________________。
(5)常温下,HClO2的电离平衡常数Ka=1.07×10-2,反应器II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中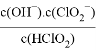 =__________。
=__________。
科目:高中化学 来源:2017届吉林省长白山市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
0.1mol·L-1的KOH与等浓度等体积的草酸(H2C2O4)溶液混合后,溶液呈酸性,则下列的说法正确的是
A. 溶液呈酸性说明草酸是弱酸
B. c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-)
C. c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)
D. c(H2C2O4)>c(C2O42-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:简答题
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
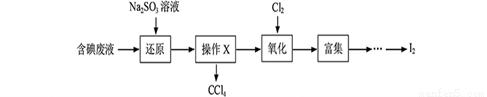
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为________________;该操作将I2还原为I-的目的是_____________________。
(2)操作X的名称为____________。
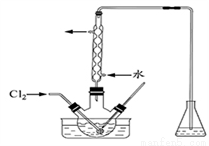
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如下图所示)。实验控制在较低温度下进行的原因是________________;锥形瓶里盛放的溶液为______________。
(4)已知:5SO32—+2IO3—+2H+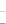 I2+5SO42—+H2O
I2+5SO42—+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3—中的一种或两种。请补充完整检验含碘废水中是否含有IO3—的实验方案(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在;_____________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列有关氢化物的叙述中正确的是
A. 一个D216O分子中所含的中子数为8 B. H2S为共价化合物
C. 在卤化氢中HI最稳定 D. 酸性:HCl>HBr
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列说法:①离子化合物含离子键,也可能含极性键或非极性键;②含金属元素的化合物不一定是离子化合物;③由非金属元素组成的化合物一定是共价化合物;④熔融状态能导电的化合物是离子化合物。其中正确的有
A. ②③④ B. ①②④
C. ①②③ D. ①③④
查看答案和解析>>
科目:高中化学 来源:2017届山东省菏泽市高三一模理综化学试卷(解析版) 题型:选择题
下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
B | 物质的量之比为2:3的稀硝酸和稀硫酸
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-1NaCl、NaI的混合溶液中滴加2滴0.01mol·L-1AgNO3溶液,振荡,沉淀是黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-1 NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第五次模拟考试理综化学试卷(解析版) 题型:简答题
研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ•mol﹣1
2C(s)+O2(g)=2CO(g) △H=﹣221.0kJ•mol﹣1
C(s)+O2(g)=CO2(g) △H=﹣393. 5kJ•mol﹣1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=_____ kJ•mol﹣1,利于
该反应自发进行的条件是_______(选填“高温”或“低温”)。

(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g),反应过程中 部分物质的浓度变化如图所示:
反应从开始到9min时,用CO2表示该反应的速率是____________________(保留2位有效数字)
②第12min时改变的条件是______________(填“升温或降温”).
③第18min时建立新的平衡,此温度下的平衡常数为______________(列计算式),第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将_____移动(填“正向”、“逆向”或“不”)。
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是________________(填序号)。
(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(4)以氨为燃料可以设计制造氨燃料电池,产物无污染。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为______________________________
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省抚顺市高三3月模拟考试理科综合化学试卷(解析版) 题型:选择题
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A. 同周期元素中X的金属性最强
B. 原子半径X>Y,离子半径X+>Z2-
C. 同族元素中Z的氢化物稳定性最高
D. 同周期元素中Y的最高价含氧酸的酸性最强
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省大庆市高三第二次教学质量检测(二模)理科综合化学试卷(解析版) 题型:简答题
以铬铁矿为原料制备铬酸钾(K2Cr2O7)的工艺流程如下图所示。铬铁矿的主要成分可表示为FeO-Cr2O3和杂质SiO2。
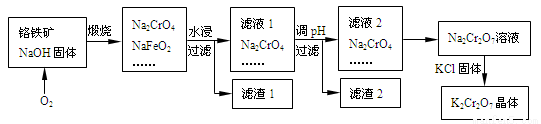
已知:①NaFeO2遇水强烈水解
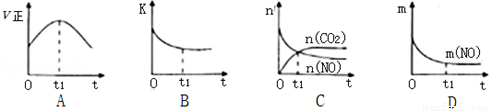
②2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
回答下列问题:
(1)K2CrO4中Cr元素的化合价是________。
(2)完成并配平煅烧铬铁矿生成Na2CrO4和NaFeO2的化学反应方程式________
FeO-Cr2O3+ O2+ NaOH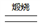 Na2CrO4+NaFeO2+ ;
Na2CrO4+NaFeO2+ ;
该反应的氧化产物是________。
(3)生成滤渣1中红褐色物质的化学反应方程式是____________。滤渣2的成分(填化学式)_______。
(4)滤液2存在平衡:2CrO42-(黄色)+2H+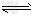 Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是______。
Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是______。
A.达到新平衡后,溶液PH一定增大
B.再达到新平衡前,正反应速率一定大于逆反应速率
C.该反应平衡常数可以不改变
D.达新平衡后,CrO42-的消耗速率等于Cr2O72-的消耗速率
(5)含铬废水中含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的危害,必须进行处理。还原沉淀法是常用的一种方法:
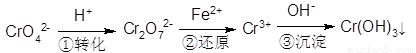
①上述流程中还原过程的离子反应方程式为:_______________。
②最终生成的Cr(OH)3在溶液中存在沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH—(aq)常温下,Cr(OH)3的Ksp=1×10-32,当c(Cr3+)降至1×10-3·mol·L-1,溶液的pH应调至4时______(填“有”或“没有”)沉淀生成。
Cr3+(aq)+3OH—(aq)常温下,Cr(OH)3的Ksp=1×10-32,当c(Cr3+)降至1×10-3·mol·L-1,溶液的pH应调至4时______(填“有”或“没有”)沉淀生成。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com