
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
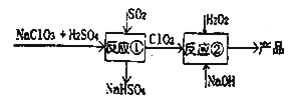
下列说法不正确的是( )
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为21
B.反应①氧化产物与还原产物的物质的量之比为1:1
C.反应②条件下,ClO2的氧化性大于H2O2反应
D.②中的H2O2可用NaClO4代替
【答案】BD
【解析】
A.反应①化学方程式为:2NaClO3+H2SO4+SO2=2NaHSO4+2ClO2因此参加反应的NaClO3和SO2的物质的量之比为2:1,选项正确,A不符合题意;
B.反应①中氧化产物为NaHSO4,还原产物为ClO2 , 二者的物质的量之比为1:2,选项错误,B符合题意;
C.反应②的化学方程式为2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O,该反应中,氧化剂为ClO2,还原剂为H2O2,因此ClO2的氧化性强于H2O2,选项正确,C不符合题意;
D.反应②中H2O2体现还原性,而NaClO4中的氯元素的化合价为+7价,氯元素的最高价态,氯元素不具有还原性,故不可用NaClO4代替H2O2 , 选项错误,D符合题意;
故答案为:BD。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】化合物H是合成一种药物的中间体,可通过以下方法合成:
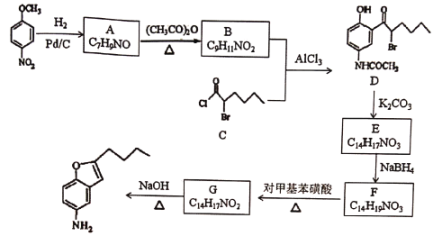
已知:①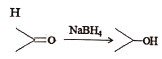 ②
②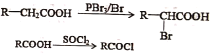
(1)化合物F的结构简式_____。
(2)下列说法正确的是_____。
A. 由反应物转化为A,E转化为F均发生了还原反应
B. 化合物F中有2个手性碳原子
C. 1molG能与5molH2发生加成反应
D.化合物H的分子式为C12H15NO
(3)写出D→E的化学方程式______。
(4)请写出以正己醇为原料制备化合物C的流程图,无机试剂任选。________________
(5)写出同时满足下列条件的B的所有同分异构体的结构简式______。①分子中只有4种不同化学环境的氢②分子中不含氮氧键、C=O③分子中只有一个环状结构,且遇FeCl3溶液显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食纤维具有突出的保健功能,是人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一——芥子醇结构简式如图所示。下列有关芥子醇的说法正确的是( )
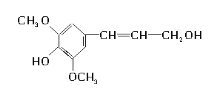
A.芥子醇分子中含9种不同化学环境的H原子
B.芥子醇分子中所有碳原子不可能在同一平面上
C.芥子醇属于芳香族化合物,分子式是C11H12O4
D.芥子醇能发生的反应类型有氧化、取代、加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容密闭容器中,充入2molCO2和6molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
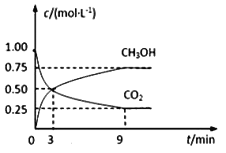
(1)0~9min内,v(H2)=__mol·L1·min1。
(2)能说明上述反应达到平衡状态的是__(填编号)。
a.反应中CO2与CH3OH的物质的量浓度之比为1:1
b.混合气体的密度不随时间的变化而变化
c.单位时间内消耗3 mol H2,同时生成1 mol H2O
d.CO2的体积分数在混合气体中保持不变
e.混合气体的压强不随时间的变化而变化
(3)平衡时H2的转化率为___。
(4)平衡时混合气体中H2O(g)的体积分数是__。
(5)一定温度下,第9分钟时v正(CH3OH)__(填“大于”、“小于”或“等于”)第3分钟时v逆 (CH3OH)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
B.氯气溶于水:Cl2+H2O ![]() H++CI-+HClO
H++CI-+HClO
C.次氯酸钙中通二氧化硫:SO2+Ca2++H2O+2ClO-=CaSO3↓+2HClO
D.水玻璃(硅酸钠水溶液)中滴加醋酸:SiO32-+2H+=H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生反应:2A(g)+B(g)![]() 2C(g) ΔH ,图1表示该反应在不同温度下B的转化率随温度变化曲线,图2表示该反应的反应速率(v)随时间(t)变化图像。
2C(g) ΔH ,图1表示该反应在不同温度下B的转化率随温度变化曲线,图2表示该反应的反应速率(v)随时间(t)变化图像。

请回答下列问题:
(1)图中a、b、c三点的化学反应速率(v)由快到慢是__________。
(2)图中该反应的ΔH_______0。
(3)图中a、b、c三点,未达到平衡状态且v正>v逆的点是_______。

请回答下列问题:
(4)图中t2时刻改变的外界条件是___________。
(5)图中从t1 ~ t6 反应物转化率最低的是_______时刻。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
____KIO3+___KI+___H2SO4=___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是______________________。
②b中反应所产生的I2的物质的量是___________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_______________________mg/kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应在工业上有广泛应用:2Al+Fe2O3 高温 2Fe+Al2O3
(1)在该反应中,Al作_______(氧化剂或还原剂);
(2)该反应中被氧化的元素是__;
(3)在上述反应方程式上标出电子转移的方向和数目。__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.金属晶体中金属原子主要有三种常见的堆积方式,体心立方堆积、面心立方堆积和六方堆积。
(1)金属铜采用下列________(填字母代号)堆积方式。
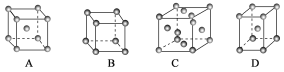
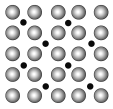
(2)洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为________________。
II.已知A、B、C、D、E五种元素都是元素周期表中前20号元素,原子序数依次增大,E的外围电子排布式为4s2。A、B、C、D四种元素在元素周期表中的相对位置如下表所示。
…… | A | ||||||
B | C | D |
根据以上信息,回答下列问题:
(1)A和B的离子中,半径较小的是________(填离子符号)。
(2)A、D分别与B形成的化合物中,________的晶格能大(填化学式)。
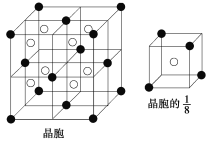
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是____________。A和E化合物的晶胞1/8的体积为2.0×10-23 cm3,求A和E组成的离子化合物的密度,请列式并计算(结果保留一位小数):__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com