
| A. | 16gO2与16gO3体积比为3:2 | |
| B. | 由H2、O2组成的混合气,密度是氢气的8.5倍,混合气中H2的质量分数为50% | |
| C. | 将标况下22.4L的HCl气体溶于1 L水中配制1mol/L的HCl溶液 | |
| D. | 1mL 3mol/L的K2SO4溶液和100mL 1mol/L的Al2(SO4)3溶液,SO42-浓度相同 |
分析 A.由n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算;
B.混和气体的密度为相同条件下H2密度的8.5倍,则混合气体的平均相对分子质量为8.5×2=17,可计算出两种气体的物质的量之比,进而计算质量关系;
C.溶液的体积不等于水的体积;
D.根据化学式中含有离子数目计算离子的浓度,与溶液的体积无关.
解答 解:A.16gO2的物质的量为0.5mol,16gO3的物质的量为$\frac{2}{3}$mol,体积与温度、压强有关,所以无法计算体积的关系,故A错误;
B.混和气体的密度为相同条件下H2密度的8.5倍,则混合气体的平均相对分子质量为8.5×2=17,
设混合气体中含有xmolH2,ymolO2,
则有$\frac{2x+32y}{x+y}$=17,
解之得x:y=1:1,
则ω(H2)=$\frac{1×2}{1×2+1×32}$×100%=5.88%,故B错误;
C.将标况下22.4L的HCl气体溶于1 L水中,溶液的体积不等于水的体积,所以无法计算溶液的物质的量浓度,故C错误;
D.1mL 3mol/L的K2SO4溶液和100mL 1mol/L的Al2(SO4)3溶液,SO42-浓度相同均为3mol/L,故D正确.
故选D.
点评 本题考查混合物的计算、物质的量的有关计算,题目难度不大,本题注意相对密度的运用,明确物质的量的有关计算公式是解题的关键,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:实验题
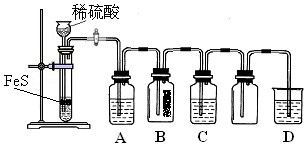 硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的很多生理过程中也起着重要作用.
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的很多生理过程中也起着重要作用.| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸中:K+、Mg2+、AlO2-、SO42- | |
| B. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | KW/c(H+)═10-13溶液中:Fe3+、NH4+、Mg2+、SO42- | |
| D. | 通大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲的分子数比乙的分子数多 | |
| B. | 甲的摩尔体积比乙的摩尔体积小 | |
| C. | 甲的相对分子质量比乙的相对分子质量大 | |
| D. | 甲的物质的量比乙的物质的量少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | D的物质的量浓度 | ||
| C. | A的物质的量浓度 | D. | 气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,44.8 LH2O含有的水分子数为2NA | |
| B. | 88gC02含有的C02分子数为2NA | |
| C. | 46gNO2气体含有的氧原子数为NA | |
| D. | 1mol的任何气体中都含有NA个原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com