
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知: SO2(g) +1/2O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时
v(正) v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
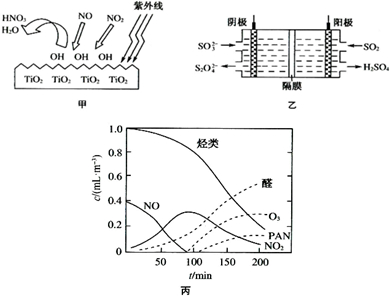
 (4)若以右图所示装置,用电化学原理生产硫酸,写
(4)若以右图所示装置,用电化学原理生产硫酸,写 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| O | 2- 4 |
| O | 2- 3 |
| O | 2- 4 |
| O | 2- 4 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
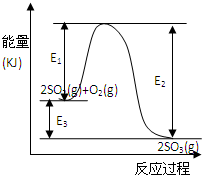 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)?2SO3(g)过程中的能量变化如图所示,回答下列问题.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)?2SO3(g)过程中的能量变化如图所示,回答下列问题.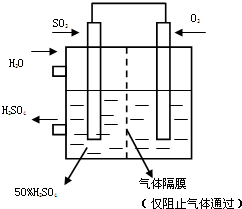
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


| ||
| △ |
| ||
| △ |
| T/K | 303 | 313 | 323 |
| CA2生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
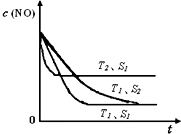 氮氧化物是大气污染物之一,消除氮氧化物的方法有多种.
氮氧化物是大气污染物之一,消除氮氧化物的方法有多种.| 180℃ |
| 催化剂 |
| ClO2 |
| 反应Ⅰ |
| Na2SO3 |
| 反应Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知1.0mol·L—1NaHSO3溶液的pH为3.5,则此溶液离子浓度从大到小的顺序为 (用离子符号表示)。
 (2)能证明Na2SO3溶液中存在水解平衡SO32-+H2O
(2)能证明Na2SO3溶液中存在水解平衡SO32-+H2O![]() HSO3-+OH-的事实是 (填序号)。
HSO3-+OH-的事实是 (填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液红色退去
B.滴入酚酞溶液变红,再加入氯水后红色退去
C.滴入酚酞溶液变红,在加入BaCl2溶液后产生沉淀且红色退去
(3)工业上利用催化氧化反应将SO2转化为SO3:2SO2+ O2 ![]() 2SO3。若某温度下,此反应的起始浓度c(SO2)=1.0mol·L—1,c(O2)=1.5mol·L—1,达到平衡后,SO2的转化率为50%,则此温度下该反应的平衡常数K= 。
2SO3。若某温度下,此反应的起始浓度c(SO2)=1.0mol·L—1,c(O2)=1.5mol·L—1,达到平衡后,SO2的转化率为50%,则此温度下该反应的平衡常数K= 。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
| 0.01mol·L-1 KIO3 酸性溶液(含淀粉)的体积/mL | 0.01mol·L-1 Na2SO3 溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
表中V2=___________mL,该实验的目的是______________ ______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com