
写出用惰性电极电解下列电解质溶液的电极反应式及电解反应的化学方程式
(1)Ba(OH)2:____________________________________________________________;
(2)Na2CO3: __________________________________________________________;
(3)KCl: ____________________________________________________________;
(4)AgNO3: ___________________________________________________________。
科目:高中化学 来源: 题型:
有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈 紫色。
紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是_____________,此液体具有的性质是________(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为____________。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸该酸的某盐常用于实验室制取氧气的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转 移时,该反应的化学方程式是_______________。
移时,该反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。达到平衡时平衡混合物中NH3的含量(体积分数)[入料V(N2)∶V(H2)=1∶3]
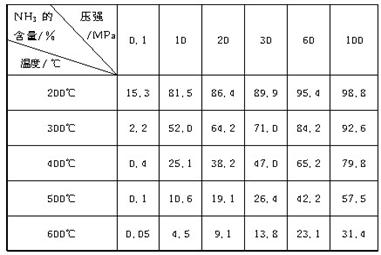
(1)比较200℃和300℃时的数据,可判断升高温度,平衡向____________方向移动,正反应方向为________(填“吸热”或“放热”)反应。
(2)根据平衡移动原理,合成氨适宜的条件是________。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(3)计算500℃,30 MPa时N2的转化率________。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施:________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:某温度时,Ksp(AgCl)=1.8×10-10 mol2·L-2,Ksp(Ag2CrO4)=1.1×10-12 mol3·L-3。
试求:
(1)此温度下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度,并比较两者的大小。
(2)此温度下,在0.010 mol·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度,并比较两者的大小。
查看答案和解析>>
科目:高中化学 来源: 题型:
能用电解原理说明的问题是( )
①电解是把电能转变成化学能 ②电解是化学能转变成电能 ③电解质溶液导电是化学变化,金属导电是物理变化 ④不能自发进行的氧化还原反应,通过电解的原理可以实现 ⑤任何溶液被电解时,必须导致氧化还原反应的发生
A.①②③④ B.②③⑤ C.③④ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:Ni2++2e-—→Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃时,将2个铜电极插入到一定的Na2SO4饱和溶液中,通直流电电解并不断搅拌,当阴极上收集到a mol气体时,溶液中析出了b mol的结晶水合物Na2SO4·10H2O,若保持温度不变,则所剩溶液中溶质的质量分数是( )
A.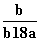 B.
B.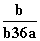 C.
C.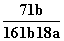 D.
D.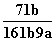
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在0.1 mol·L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序为[Na+]>[HSO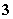 ]>[SO
]>[SO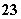 ]>[H2SO3]。
]>[H2SO3]。
(1)该溶液中[H+]________[OH-](填“>”、“<”或“=”),简述理由:
________________________________________________________________________
________________________________________________________________________。
(2)现向NH4HSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是________________________________________________________________________
________________________________________________________________________;
写出该反应的离子方程式
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的稀盐酸跟过量锌粉反应时,为了加快反应速率又不影响生成H2的总量,可采取的措施是( )
A.加入少量稀氢氧化 钠溶液
钠溶液
B.加入少量CH3COONa固体
C.加入少量NH4HSO4固体
D.加入少量CuSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com