
| A. | (NH4)2SO4浓溶液和CuSO4溶液都能使蛋白质沉淀析出 | |
| B. | 苯中含有碳碳双键,其性质跟乙烯相似 | |
| C. | 乙烯使溴水褪色和苯与溴水混合振荡后水层变为无色原理相同 | |
| D. | 聚乙烯塑料的老化是由于发生了加成反应 |
分析 A.(NH4)2SO4浓溶液和CuSO4溶液分别使蛋白质发生盐析、变性;
B.苯中不含碳碳双键;
C.乙烯与溴水发生加成反应,苯与溴水发生萃取;
D.聚乙烯不含碳碳双键.
解答 解:A.(NH4)2SO4浓溶液和CuSO4溶液分别使蛋白质发生盐析、变性,则都有沉淀生成,故A正确;
B.苯中不含碳碳双键,苯中的键为介于单键和双键之间特殊的化学键,与乙烯性质不同,故B错误;
C.乙烯与溴水发生加成反应,苯与溴水发生萃取,褪色原理不同,故C错误;
D.聚乙烯不含碳碳双键,不能发生加成反应,塑料老化与氧化有关,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应等为解答的关键,侧重分析与应用能力的考查,注意判断有机物中的官能团,题目难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题
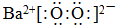 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
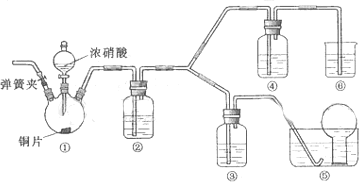
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
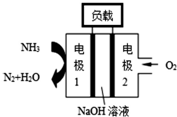 ①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2═2ZnO.则该电池的负极材料是锌;当导线中有1mol电子通过时,理论上消耗的O2在标准状况下的体积是5.6L.
①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2═2ZnO.则该电池的负极材料是锌;当导线中有1mol电子通过时,理论上消耗的O2在标准状况下的体积是5.6L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
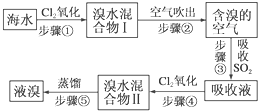
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰乳与碳酸钠溶液反应:Ca2++CO32-=CaCO3↓ | |
| B. | NH4HSO3溶液与足量的氢氧化钠溶液混合加热:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+SO32-+2H2O | |
| C. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH- | |
| D. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O=AgOH↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 | |
| B. | 向某恒容密闭容器中通入1mol SO2和0.5 molO2,达到平衡时放出热量为98.5 kJ | |
| C. | 升高温度能使逆反应速率加快,正反应速率减慢 | |
| D. | 向某恒容密闭容器中通入一定量的SO2和O2达到平衡后,再通入少量气体He,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
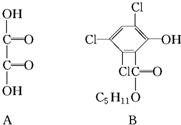 化合物A、B可合成荧光“魔棒”中产生能量的物质之一(CPPO).
化合物A、B可合成荧光“魔棒”中产生能量的物质之一(CPPO).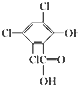 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 医用消毒酒精中乙醇的浓度为75% | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 糖类、油脂和蛋白质均为高分子化合物,均可发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com