
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
压强/MPa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
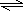 2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+
2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+| 1 |
| 2 |
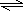 SO3(g)△H=-Q1 KJ/mol
SO3(g)△H=-Q1 KJ/mol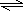 2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+
2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+| 1 |
| 2 |
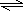 SO3(g)△H=-Q1 KJ/mol
SO3(g)△H=-Q1 KJ/mol| 50Q2 |
| Q1 |
| 50Q2 |
| Q1 |
| 1 |
| 9 |
| 1 |
| 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)工业上可用下列装置来测定黄铁矿中硫的质量分数(忽略SO2、H2SO3与氧气的反应)
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取,分液
H.取20.00mL吸收液,用标准0.2000mol·L-1的NaOH溶液滴定。
试回答:
(1)已知:4FeS2 + 11 O2 = 2Fe2O3+8SO2 如12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的热化学方程式是 。
(2)步骤G中所用主要仪器是 ,应取 (填“上”或“下” )层溶液进行后续实验。
(3)装置①的作用是 。
(4)步骤H中滴定时应选用 作指示剂
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收。滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.58 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
则硫铁矿样品中硫元素的质量分数为 (保留小数点后1位)
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂 。
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省正定中学高二上学期期末考试化学试卷 题型:实验题
(12分)工业上可用下列装置来测定黄铁矿中硫的质量分数(忽略SO2、H2SO3与氧气的反应)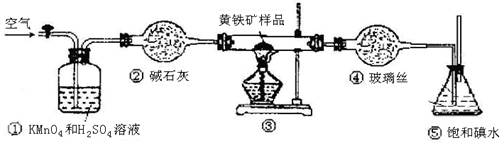
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取,分液
H.取20.00mL吸收液,用标准0.2000mol·L-1的NaOH溶液滴定。
试回答:
(1)已知:4FeS2 + 11 O2 = 2Fe2O3+ 8SO2 如12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的热化学方程式是 。
(2)步骤G中所用主要仪器是 ,应取 (填“上”或“下” )层溶液进行后续实验。
(3)装置①的作用是 。
(4)步骤H中滴定时应选用 作指示剂
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收。滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.58 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二上学期期末考试化学试卷 题型:实验题
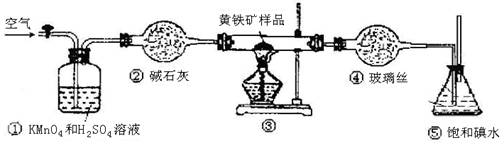
(12分)工业上可用下列装置来测定黄铁矿中硫的质量分数(忽略SO2、H2SO3与氧气的反应)
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取,分液
H.取20.00mL吸收液,用标准0.2000mol·L-1的NaOH溶液滴定。
试回答:
(1)已知:4FeS2 + 11 O2 = 2Fe2O3+ 8SO2 如12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的热化学方程式是 。
(2)步骤G中所用主要仪器是 ,应取 (填“上”或“下” )层溶液进行后续实验。
(3)装置①的作用是 。
(4)步骤H中滴定时应选用 作指示剂
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收。滴定得到的数据如表所示:
|
滴定次数 |
待测液体的体积/mL |
标准碱溶液的体积/mL |
|
|
滴定前 |
滴定后 |
||
|
第一次 |
20.00mL |
0.00 |
20.58 |
|
第二次 |
20.00mL |
0.22 |
20.20 |
|
第三次 |
20.00mL |
0.36 |
20.38 |
则硫铁矿样品中硫元素的质量分数为 (保留小数点后1位)
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂 。
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com