
【题目】某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。请回答:

(1)装置A中发生反应的化学方程式为_______________。
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是_________。(填酸液或碱液)
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中长颈漏斗内液面上升,广口瓶内液面下降,则B中应放置的液体是(填字母)___。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和V L 18 mol·L-1硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_____________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是__(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
③实验结束时测得铜减少了3.2 g,则被还原的硫酸的物质的量为_____mol;转移的电子为_____mol;反应后溶液中硫酸根离子的物质的量浓度为_________mol·L-1。(反应后溶液的体积为V L)
【答案】 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 碱液 d 随着反应的进行,浓硫酸变为稀硫酸,而铜不能与稀硫酸反应 ad 0.05 0.1 (18V-0.05)/V
CuSO4+SO2↑+2H2O 碱液 d 随着反应的进行,浓硫酸变为稀硫酸,而铜不能与稀硫酸反应 ad 0.05 0.1 (18V-0.05)/V
【解析】(1)铜跟浓硫酸反应,铜具有还原性,浓硫酸具有强氧化性,反应必须加热才能发生,书写化学方程式时注意“浓”字,反应的化学方程式为: Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O ;(2)二氧化硫有毒,不能直接排放,氢氧化钠溶液能够与二氧化硫反应,可用浸有NaOH溶液的棉团塞在试管口吸收二氧化硫,装置D中试管口放置的棉花中应浸一种液体,这种液体是碱液;(3)装置B的作用是贮存多余的气体,所以B中应放置的液体不能与二氧化硫反应,也不能溶解二氧化硫,而a.二氧化硫和水生成亚硫酸、b.酸性KMnO4溶液氧化二氧化硫、C.浓溴水和二氧化硫生成硫酸和氢溴酸,它们都能够与二氧化硫反应,只有d.饱和NaHSO3溶液符合要求,故选d;(4)①有一定量的余酸但未能使铜片完全溶解,原因是随着反应的进行,浓硫酸变为稀硫酸,而铜不能与稀硫酸反应。②证明反应后有硫酸剩余,需要证明反应后的溶液中存在大量氢离子,根据金属活动顺序表可知铁能和氢离子反应,稀硫酸与BaCl2溶液反应生成硫酸钡,但是不能证明是否含有氢离子;银与氢离子不反应,不能证明溶液中含有氢离子,与饱和Na2CO3溶液反应生成二氧化碳,证明溶液中含有氢离子,故选ad;
CuSO4+SO2↑+2H2O ;(2)二氧化硫有毒,不能直接排放,氢氧化钠溶液能够与二氧化硫反应,可用浸有NaOH溶液的棉团塞在试管口吸收二氧化硫,装置D中试管口放置的棉花中应浸一种液体,这种液体是碱液;(3)装置B的作用是贮存多余的气体,所以B中应放置的液体不能与二氧化硫反应,也不能溶解二氧化硫,而a.二氧化硫和水生成亚硫酸、b.酸性KMnO4溶液氧化二氧化硫、C.浓溴水和二氧化硫生成硫酸和氢溴酸,它们都能够与二氧化硫反应,只有d.饱和NaHSO3溶液符合要求,故选d;(4)①有一定量的余酸但未能使铜片完全溶解,原因是随着反应的进行,浓硫酸变为稀硫酸,而铜不能与稀硫酸反应。②证明反应后有硫酸剩余,需要证明反应后的溶液中存在大量氢离子,根据金属活动顺序表可知铁能和氢离子反应,稀硫酸与BaCl2溶液反应生成硫酸钡,但是不能证明是否含有氢离子;银与氢离子不反应,不能证明溶液中含有氢离子,与饱和Na2CO3溶液反应生成二氧化碳,证明溶液中含有氢离子,故选ad;
③Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 被还原的硫酸 2e-
CuSO4+SO2↑+2H2O 被还原的硫酸 2e-
64g 2mol 1mol 2mol
3.2g n(H2SO4) n(电子)
实验结束时测得铜减少了3.2 g,则被还原的硫酸的物质的量为 n(H2SO4)=3.2g×1mol/ 64g= 0.05mol;转移的电子为n(电子)=3.2g×2mol/ 64g=0.1mol;反应后溶液中硫酸根离子的物质的量浓度为 n(SO42-)=(18 mol·L-1×VL-0.05mol)/VL= (18V-0.05)/Vmol·L-1。(反应后溶液的体积为V L)


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.58 g乙烯和乙烷的混合气体中碳原子数目一定为4NA
B.用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA
C.已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 如果有5mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA
D.142g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠(NaCN)是一种重要的化工原料、有剧毒,一旦泄露可以通过喷洒双氧水或硫代硫酸钠溶液来处理. 已知:氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3═NaSCN+Na2SO3回答下列问题:
(1)氰化物中碳的化合价为;用硫代硫酸钠处理1mol NaCN时,反应中转移电子的物质的量为.
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是.
(3)某化学兴趣小组在实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放. 【实验一】制备Na2S2O3 , 其实验室装置如下:
①b装置的作用是;c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3 , 还可能有 .
②实验结束后,在e处最好连接盛(填化学式)的注射器,再关闭K2打开K1 , 以防拆除装置过程中的有害气体污染空气.
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量.
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN﹣=[Ag(CN)2]﹣ , Ag++I﹣=AgI↓,AgI呈黄色,且CN﹣优先于Ag+反应.
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10﹣4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL.
③滴定时1.000×10﹣4mol/L的标准AgNO3溶液应用(填仪器名称)盛装;滴定终点时的现象是 .
④处理后的废水是否达到排放标准:(填“是”或“否”),其依据是(用实验数据说明).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化关系如图所示。已知X的原子半径在所有原子中最小;Y的一种核素的质量数为15,中子数为8;W的最高价氧化物的水化物在含氧酸中酸性最强。下列说法不正确的是( )

A. X元素有多种核素
B. X与Y可形成YX3型共价化合物
C. Y元素的电负性一定小于Z元素
D. W元素的单质有强氧化性,它不可能与水发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卢瑟福的α粒子轰击金箔的实验说明了
①原子中绝大部分是中空的
②葡萄干面包原子模型理论是正确的
③原子內存在着很小的带正电荷的核
A.①②B.①③C.①②③D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列原子构成的单质中既能与稀硫酸反应又能与烧碱溶液反应且都产生H2的是( )
A.核内无中子的原子
B.外围电子排布为3s23p3
C.最外层电子数等于倒数第三层的电子数的原子
D.N层上无电子,最外层的电子数等于电子层数的金属原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl﹣)生产CuCl的流程: 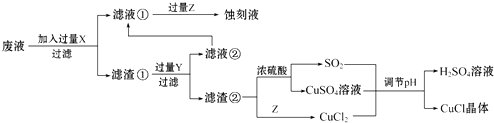
根据以上信息回答下列问题:
(1)生产过程中X的化学式为 .
(2)写出产生CuCl的化学方程式: .
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由 . 实际生产中SO2要适当过量,原因可能是(答一点即可).
(4)实验探究pH对CuCl产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为 , 当pH较大时CuCl产率变低原因是 . 调节pH时,(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是 .
(5)氯化亚铜的定量分析: ①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解.
②用0.10molL﹣1硫酸铈标准溶液滴定.已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+ . 三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为(结果保留三位有效数字).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com