
| A. | 碱性氧化物一定是金属氧化物,金属氧化物一定是碱性氧化物 | |
| B. | 由一种元素组成的物质一定是单质,两种元素组成的物质一定是化合物 | |
| C. | 非金属氧化物不一定是酸性氧化物,酸性氧化物不一定都是非金属氧化物 | |
| D. | 硫酸、纯碱、石膏是按酸、碱、盐排列的 |
分析 A.碱性氧化物都是金属氧化物,金属氧化物有酸性氧化物、碱性氧化物、过氧化物和两性氧化物等;
B.由一种元素组成的物质一定是单质,两种元素组成的物质一定是化合物
C.金属氧化物可分为酸性、碱性、两性氧化物,酸性氧化物也可能是金属氧化物,非金属氧化物不一定是酸性氧化物;
D.纯碱是碳酸钠属于盐;
解答 解:A.碱性氧化物都是金属氧化物,但金属氧化物不一定是碱性氧化物,如酸性氧化物Mn2O7,两性氧化物氧化铝,故A错误;
B.一种元素可以组成不同的单质,比如氧元素能组成氧气和臭氧,两种元素组成的物质不一定是化合物,比如氧气和氢气的混合物,故B错误;
C.金属氧化物可分为酸性、碱性、两性氧化物,所以酸性氧化物也可能是金属氧化物,如Mn2O7是金属氧化物,属于酸性氧化物,非金属氧化物不一定是酸性氧化物,如CO、NO等,故C正确;
D.硫酸、纯碱、石膏是按酸、盐、盐排列的,故D错误;
故选C.
点评 本题考查氧化物的概念及其联系,题目难度不大,但概念间的联系是学习的难点,属于易错题,注意两性氧化物和不成盐氧化物的性质.


科目:高中化学 来源: 题型:选择题
| A. | 2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量 | |
| B. | 在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量 | |
| C. | 1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| D. | 1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取、分液前需对分液漏斗检漏 | |
| B. | 进行分液时,分液漏斗中的下层液体从下端流出,上层液体则从上口倒出 | |
| C. | 为保证分液漏斗内的液体顺利流出,需将分液漏斗上面的塞子打开 | |
| D. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将称量NaOH固体时在烧杯中溶解后立即转移到容量瓶中 | |
| B. | 向容量瓶中加水定容时俯视 所配溶液浓度偏高 | |
| C. | 配制NaOH溶液不需用到量筒 | |
| D. | 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③ | C. | ②③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+ )+c(M+ )=c(OH- )+c(A- ) | |
| B. | pH 相等的 NaHCO3、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(NaHCO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO- )+2c(OH- )=2c(H+ )+c(CH3COOH) | |
| D. | 0.1mol•L-1 的NaHA溶液,其pH=4:c(HA- )>c(H+ )>c(H2A)>c(A2- ) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
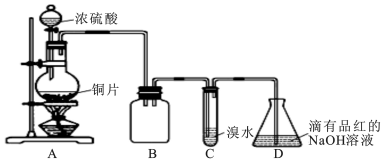
| 序号 | 实验操作 | 预期现象及结论 |
| ① | 取上述混合溶液于试管A中,加入少量CaCO3固体,充分振荡. | 若固体溶解,产生气泡,则Ⅰ或Ⅱ成立. |
| ② | 继续向试管A中滴加溴水,充分振荡. | 若溶液褪色,结合步骤①,则Ⅱ成立;若溶液不褪色,结合步骤①,则Ⅰ成立 |
| ③ | 另取上述混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡. | 溶液变为蓝色,则Ⅲ成立. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com