
(1)估计下列各变化过程是熵增还是熵减。
①NH4NO3爆炸:2NH4NO3(s)===2N2(g)+4H2O(g)+O2(g)
②水煤气转化:CO(g)+H2O(g)===CO2(g)+H2(g)
③臭氧的生成:3O2(g)===2O3(g)
(2)可逆反应A(g)+B(g)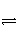
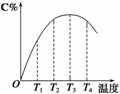
 2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如右图所示。
2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如右图所示。
①由T1向T2变化时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
②由T3向T4变化时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
③反应在________温度下达到平衡。
④此反应的正反应为______热反应。
答案 (1)①熵增 ②熵变很小 ③熵减 (2)①> ②< ③T3 ④放
解析 (1)对于有气体参与的化学反应(有气体参与反应时气体既可以是反应物也可以是产物),气体的物质的量增大的化学反应,其熵变通常是正值,即是熵增大的反应;反之,气体的物质的量减小的化学反应,其熵变通常是负值,即是熵减小的反应。若反应物中气体的物质的量与产物中气体的物质的量相等,其熵变通常都是很小的值,正负由具体的化学反应体系来决定。
NH4NO3的爆炸反应是气态物质的物质的量增大的化学反应,(2+4+1)-(0)>0,因此该过程是熵增的过程。水煤气转化反应,气态物质的物质的量反应前后未发生变化,即(1+1)-(1+1)=0,估计该过程的熵变很小。生成臭氧后,气态物质的物质的量减小,即2-3<0,因此该过程是熵减的过程。
(2)①由T1向T2变化时即温度由T1升高到T2时,C%逐渐增大,说明此时反应未达平衡,温度升高,使得反应速率加快,而且正反应的反应速率要大于逆反应的反应速率,即v(正)>v(逆)。
②由T3向T4变化时,C%逐渐减小,说明在温度由T3升高到T4时,反应速率虽然提高,但是正反应的反应速率要小于逆反应的反应速率,即v(正)<v(逆),导致C%随温度升高而减小。
③化学反应达到平衡时,正反应的反应速率等于逆反应的反应速率,即v(正)=v(逆),由图示可知反应在T3温度下达到平衡。
④从图中可以看出,随着反应温度的继续升高,C%反而下降,可知正反应是放热反应。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
下列事实与胶体知识有关的是( )
①用盐卤点豆腐;②生产出果冻;③用明矾净水;④河海交汇处可沉积成沙洲;⑤初冬凌晨的迷雾的形成
A. ①②③ B. ②③④ C. ①③⑤ D.全部都是
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
A.石油、煤、天然气、氢气都属于化石燃料
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH<0
C.人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,某物质的热值越高则其标准燃烧热越大
D.两个体积相同的容器中充入等量的NO2发生反应:2NO2(g)
 N2O4(g) ΔH<0,绝热容器中气体的颜色比恒温容器中颜色深
N2O4(g) ΔH<0,绝热容器中气体的颜色比恒温容器中颜色深
查看答案和解析>>
科目:高中化学 来源: 题型:
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)
 CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
B.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
C.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
D.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
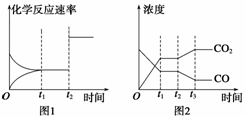
在1 L密闭容器中通入2 mol 氨气,在一定温度下发生反应:2NH3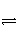
 N2+3H2,达平衡时,N2的物质的量分数为a%,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a%的是( )
N2+3H2,达平衡时,N2的物质的量分数为a%,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a%的是( )
A.3 mol H2和1 mol N2
B.2 mol NH3和1 mol N2
C.2 mol N2和3 mol H2
D.0.1 mol NH3、0.9 mol N2、2.85 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
将不同量的H2O(g)和CO气体分别通入到一体积为1 L的恒容密闭容器中进行反应:H2O(g)+CO(g)
 CO2(g)+H2(g);得到以下三组数据,据此回答下列问题:
CO2(g)+H2(g);得到以下三组数据,据此回答下列问题:
| 实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所需时间 | ||
| H2O | CO | H2 | CO | |||
| 1 | 650℃ | 1 mol | 2 mol | 0.8 mol | 1.2 mol | 5 min |
| 2 | 900℃ | 0.5 mol | 1 mol | 0.2 mol | 0.8 mol | 3 min |
| 3 | 900℃ | a | b | c | d | t |
(1)①由以上数据,实验1中以v(CO2)表示的反应速率为__________。
②该反应在650℃时平衡常数数值为__________,该反应的逆反应为________(填“吸”或“放”)热反应。
③若实验3和实验2中CO的百分含量相同,且t<3 min,则a、b应满足的关系是__________。
(2)下图1、2表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的情况:
①图1中时刻t2发生改变的条件可能是____________(写一条即可,下同)。
②图2中时刻t2发生改变的条件可能是______________________________________。
(3)在850 ℃时,其平衡常数K=1,850 ℃时在该容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2,5.0 mol H2,此时反应向________(填“正反应”或“逆反应”)方向进行,平衡时CO2的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
阿波罗宇宙飞船上使用的是氢氧燃料电池,其电极总反应式为2H2+O2===2H2O;电解质溶液为KOH溶液,反应保持在较高温度,使水蒸发,下列叙述正确的是
( )。
A.此电池能见到浅蓝色火焰
B.H2为正极,O2为负极
C.工作时电解液的OH-的物质的量不断增加
D.电极反应为负极H2失电子;正极O2得电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是 ( )。
A.当两种原子的电负性相差很大时,相互之间通常形成离子键
B.不含金属元素的化合物不一定是共价化合物
C.HCl分子中的共价键是由氢原子的1s轨道和氯原子的3s轨道重叠形成的
D.四氯化碳分子中含四个共价单键,为正四面体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com