
下列实验设计能够成功的是
| 实验目的 | 实验步骤及现象 |
A | 检验亚硫酸钠试样是否变质 |
|
B | 检验某盐是否为铵盐 |
|
C | 证明酸性条件H2O2氧化性比I2强 |
|
D | 除去氯化钠晶体中少量硝酸钾 |
|
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源:2013-2014山东省乳山市下学期期中考试高一化学试卷(解析版) 题型:简答题
(13分)有A、B、C、D、 E、R六种短周期元素,其元素特征信息如下表:
E、R六种短周期元素,其元素特征信息如下表:
元素编号 | 元素特征信息 |
A | 其单质是密度最小的物质 |
B | 其阴离子带两个单位的负电荷,单质是空气主要成分之一 |
C | 其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的1/4 |
D | 其氢氧化物和氧化物都有两性,且与C同周期 |
E | 与C同周期,其原子半径在该周期最小 |
R | 有多种化合价,其最高正价为+6价 |
回答下列问题:
(1)写出下列元素的名称:C ,E ;画出B的阴离子结构示意图: 。
(2)B、C、D的简单离子半径由大到小的顺序是 (用化学式表示)。E元素的最高价含氧酸的化学式是 ;
(3)实验证明D的氢氧化物(或氧化物)具有两性的操作方法是: 。
(4)在一定条件下,RO32-与R2-可发生反应:RO32-+2R2-+6H+ = 3R+3H2O,下列有关叙述中,正确的是 (填序号)。
A.元素R位于周期表中第3 周期,ⅥA族
B.R2-与氖原子电子层结构相同
C.RO32-在它能发生的所有反应中都只具有氧化性
D.反应中消耗1 mol RO32- ,转移的电子的物质的量为4 mol
(5)请写出涉及上述元素间的两个反应的离子方程式,要求:(1)单质之间的置换 (2)在方程式中如为两种非金属则必须是不同主族的。 ; 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三5月二模理综化学试卷(解析版) 题型:选择题
下列有关实验的叙述正确的是
A.酸式滴定管注入Na2CO3溶液之前应检查是否漏液
B.制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
C.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
D.除去Fe(OH)3固体中少量:Mg(OH)2加入足量饱和FeCl3溶液,充分搅拌后过滤
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省下学期高二期末化学模拟试卷(解析版) 题型:选择题
某烯烃与H2加成后的产物是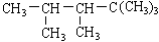 , 则其结构式可能有
, 则其结构式可能有
A.1种B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省东营市高三第二次模拟理科综合化学试卷(解析版) 题型:简答题
(12分)【化学-物质结构与性质】
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
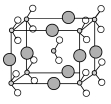
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省东营市高三第二次模拟理科综合化学试卷(解析版) 题型:选择题
化学与人类生产、生活、社会可持续发展密切相关。下列有关说法错误的是
A.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
B.在汽车排气管上加装“催化转化器”是为了减少有害气体的排放
C.硬铝属于合金材料,瓷器属于硅酸盐制品
D.食醋可去除水垢,NH4Cl溶液可去除铁锈
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省蚌埠市高三第二次教学质量检测理科综合化学试卷(解析版) 题型:选择题
太阳能电池板面对太阳时,一部分电能直接供给“天宫一号”,一部分电能则储存在电池里,供背离太阳时使用。“天宫一号”使用的是镍氢电池,电解质溶液显碱性。其反应方程式为: LaNi5+Ni(OH)2 LaNi5H+NiOOH。下列有关说法不正确的是
LaNi5H+NiOOH。下列有关说法不正确的是
A.放电时镍被还原 B.放电时负极LaNi5H+OH——e—=LaNi5+H2O
C.充电时OH—向阴极移动 D.充电时每消耗lmol Ni(OH)2转移lmol电子
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省皖南八校高三第三次联考理综化学试卷(解析版) 题型:填空题
(15分).钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。工业上常以钛矿石(主要成分为FeTiO3(钛酸亚铁),并含FeO、A12O3、 SiO2等杂质)为主要原料经过以下流程制得TiO2,并获得副产品FeSO4·7H2O.
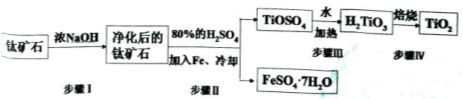
请回答下列问题:
(l)步骤I的目的是
(2)写出步骤Ⅱ中FeTiO3与H2SO4反应的化学方程式 。
(3)步骤II中经过 、 、过滤、洗涤等操作可以得到FeSO4·7H2O.晶体,还可以利用酸化的FeSO4溶液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水).该反应的离子方程式为
(4)请结合化学用语用化学平衡理论解释步骤III中将TiOSO4转化为H2TiO3的原理:
(5)为测定步骤II后溶液中TiOSO4的含量,首先取待测钛液10 mL加水稀释至100 mL,再加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,以KSCN溶液为指示剂,用0.1000 mol·L-1 NH4Fe(SO4)2溶液滴定至终点,再重复2次,测得平均值为30.00mL。
①该滴定达到终点时的现象
②待测钛液中TiOSO4的物质的量浓度是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省高二(下)期末考试化学试卷(解析版) 题型:选择题
常温下,下列各组微粒在指定的溶液中一定能大量共存的是
A.c(OH—)=10—13mol·L—1的溶液中:Na+、NH4+、Cl—、NO3—
B.1.0 mol·L—1KI溶液中:Mg2+、Fe2+、SO42—、C1O—
C.c(Fe3+)=0.1 mol·L-1的溶液中:Na+、NH4+、HCO3-、SCN—
D.饱和氨水中:NH4+、Ag+、SO42-、NO3—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com