
无色透明溶液中能大量共存的离子组是( )
A.Na+、Al3+、HCO 、NO
、NO
B.AlO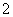 、Cl-、Mg2+、K+
、Cl-、Mg2+、K+
C.NH 、Na+、CH3COO-、NO
、Na+、CH3COO-、NO
D.Na+、NO 、Cl-、I-
、Cl-、I-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列关于极性键的叙述中不正确的是( )
A.是由不同元素原子形成的共价键
B.共价化合物中必定存在极性键
C.极性键中电负性大的原子显正电性
D.共用电子对必然偏向吸引电子能力强的原子一方
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)现有0.1 mol·L-1的纯碱溶液,用pH试纸测定溶液的pH,其正确的操作是__________。
你认为该溶液pH的范围一定介于________之间。
(2)为探究纯碱溶液呈碱性是由CO 引起的,请你设计一个简单的实验方案:____________________________。
引起的,请你设计一个简单的实验方案:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:CH3COOH??CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka= ;CH3COO-+H2O??CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
;CH3COO-+H2O??CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh= (式中各粒子浓度均为平衡时浓度)。
(式中各粒子浓度均为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是______________________,由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·L-1的CH3COOH溶液中c(H+)=________(不为0)。
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;
②________________________________________________________________________;
③用____________(填一种实验方法)测定溶液浓度c′。
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
(4)证明NaHSO3溶液中HSO 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是__________。
(5)取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,Na2CO3溶液中存在CO +H2O??HCO
+H2O??HCO +OH-平衡。下列说法不正确的是( )
+OH-平衡。下列说法不正确的是( )
A.稀释溶液, 增大
增大
B.通入CO2,溶液pH减小
C.升高温度,平衡常数增大
D.加入NaOH固体, 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式表达正确的是( )
A.用惰性电极电解熔融氯化钠:2Cl-+2H2O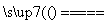 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-===2AlO +H2O
+H2O
C.用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2===NO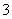 +NO↑+H2O
+NO↑+H2O
D.用食醋除去水瓶中的水垢:CO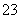 +2CH3COOH===2CH3COO-+CO2↑+H2O
+2CH3COOH===2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于乙醇的说法不正确的是( )
A.可用纤维素的水解产物制取
B.可由乙烯通过加成反应制取
C.与乙醛互为同分异构体
D.通过取代反应可制取乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com