
| A、充电时转移1mol电子则生成0.5mol H2SO4 |
| B、放电时正极的电极反应为:PbO2+4H++SO42-+2e-=PbSO4+2H2O |
| C、充电时,电池上标注“+”的电极应与外接电源的正极相连 |
| D、放电时,Pb失电子发生氧化反应 |
| ||
| 充电 |
| ||
| 充电 |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
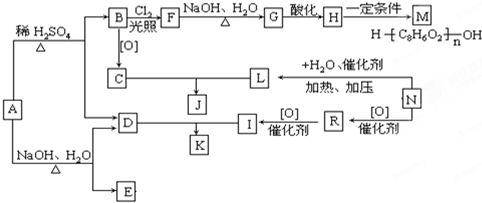

| NaOH、H2O |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(HCOO-)<c(Na+) |
| B、c(HCOO-)>c(Na+) |
| C、c(HCOO-)=c(Na+) |
| D、c(Na+)=c(HCOO-)+c(HCOOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
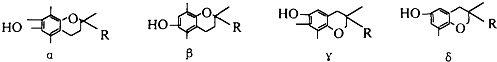
| A、α β |
| B、β γ |
| C、γδ |
| D、α δ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1个金属原子失去电子的多少 |
| B、1摩金属失去电子的多少 |
| C、原子失去电子能力的大小 |
| D、1摩金属与水反应放出H2的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在H2O2+Cl2→2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子 |
| B、9克甲基中含有的电子数为10NA |
| C、常温常压下,46克二氧化氮和四氧化二氮混合物中含3NA个原子 |
| D、1mol含五个碳原子的有机物,最多形成4mol碳碳单键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com