
| A. | 相同温度下,1mol/L氨水溶液与0.5mol/L氨水溶液中C(OH-)之比是2:1 | |
| B. | 0.1mol/LNH4Cl溶液中C(Cl-)=C(NH4+) | |
| C. | 向0.1mol/LNaNO3溶液中滴加稀盐酸,使溶液PH=5,此时混合液中C(Na+)=C(NO3-) | |
| D. | 向CH3COONa溶液中加入适量CH3COOH,使混合液的PH>7,此时混合液中C(CH3COOH)>C(CH3COO-) |
分析 A.相同温度下,不同浓度的同一电解质溶液中,浓度越小其电离程度越大;
B.氯化铵溶液中,铵根离子易水解,氯离子不水解;
C.根据物料守恒判断;
D.混合液的PH>7,溶液显碱性,则需溶液中的CH3COONa浓度远大于CH3COOH的浓度,据此分析.
解答 解:A.相同温度下,1mol/L氨水与0.5mol/L氨水中,一水合氨是弱电解质,氨水浓度越小其电离程度越大,所以C(OH-)之比小于2:1,故A错误;
B.氯化铵溶液中,铵根离子易水解,氯离子不水解,所以c (NH4+)<c (Cl-),故B错误;
C.硝酸钠是强酸强碱盐,钠离子和硝酸根离子都不水解,根据物料守恒得c(Na+)=c(NO3- ),故C正确;
D.由于通常弱电解质的电离程度大于其对应盐的水解程度,故当将等浓度的CH3COONa和CH3COOH混合时,溶液显酸性,故要使混合液的PH>7,溶液显碱性,则需溶液中的CH3COONa浓度远大于CH3COOH的浓度,而无论是盐的水解程度还是弱电解质的电离程度均很小,故溶液中的C(CH3COOH)<C(CH3COO-),故D错误.
故选C.
点评 本题考查了弱电解质溶液中和能水解的盐溶液中离子浓度的大小比较,较易出错的是D.


科目:高中化学 来源: 题型:选择题
| A. | 反应过程中MnO2作催化剂 | B. | 盐酸未反应完 | ||
| C. | 被还原的HCl少于0.2mol | D. | 反应产生2.24L氯气(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 +3NaOH$\stackrel{水}{→}$
+3NaOH$\stackrel{水}{→}$ +CH3COONa+2H2O
+CH3COONa+2H2O

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
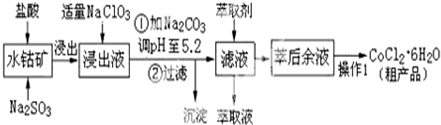
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
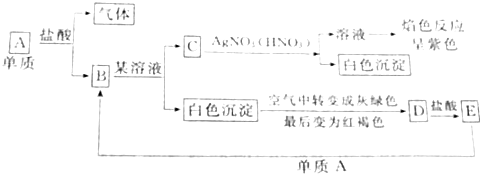 根据图示填空:
根据图示填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将80 g NaOH溶于2 L 水所得的溶液 | |
| B. | 将0.5 mol•L-1的NaNO3溶液100 mL 加热蒸发掉50 g水所得的溶液 | |
| C. | 将40 g NaOH 溶于水并配成1 L的溶液 | |
| D. | 含K+为4 mol•L-1的K2SO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com