
【题目】环氧乙烷(![]() )可用作一次性医用口罩的灭菌剂。通常可用以下两种方法制备:
)可用作一次性医用口罩的灭菌剂。通常可用以下两种方法制备:
① 氯代乙醇法:CH2=CH2+Cl2+Ca(OH)2→![]() +CaCl2+H2O
+CaCl2+H2O
② 银催化氧化法:2CH2=CH2+O2→2![]()
下列说法错误的是( )
A.方法① 和② 均为氧化还原反应
B.环氧乙烷分子中所有原子不可能处于同一平面
C.环氧乙烷用作灭菌剂是因为其强氧化性
D.方法② 的反应类型为加成反应,原子利用率100%且原料更环保
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某稀溶液中含有3.5 mol KNO3和2.2 mol H2SO4,向其中加入1.2 mol Fe,充分反应(已知NO![]() 被还原为NO)。下列说法正确的是
被还原为NO)。下列说法正确的是
A.反应过程中转移的电子数3NA
B.反应后生成NO的体积为24.64 L
C.所得溶液中c(Fe2+)∶c(Fe3+)=1∶3
D.所得溶液中c(NO3-)=2.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在Fe2+、NO3-、Fe3+、NH4+、H+和水六种粒子,在反应过程中测得Fe3+、NO3-的物质的量随时间变化的曲线如图所示,下列有关判断错误的是( )
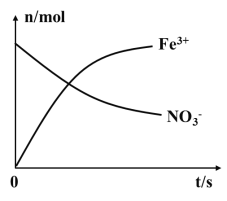
A.在反应中NO3-被还原,发生还原反应
B.还原性:Fe2+>NH4+
C.该反应中Fe2+被氧化为Fe3+
D.在反应中参加反应的还原剂与氧化剂的物质的量之比为6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对实验的装置、药品、操作和现象的预测中都正确的是( ):
A. 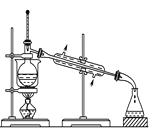 可从含碘的苯溶液里分离出碘单质并回收苯溶剂
可从含碘的苯溶液里分离出碘单质并回收苯溶剂
B. 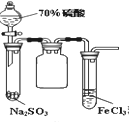 当70%H2SO4跟Na2SO3粉末混合后,可观察到右端试管内出现淡黄色浑浊
当70%H2SO4跟Na2SO3粉末混合后,可观察到右端试管内出现淡黄色浑浊
C. 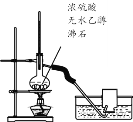 当将烧瓶内液体迅速升温至170℃时,可用排水法收集到乙烯气体
当将烧瓶内液体迅速升温至170℃时,可用排水法收集到乙烯气体
D. 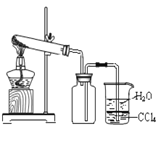 将盛氯化铵和消石灰固体的试管加热,可制取并收集到干燥的NH3
将盛氯化铵和消石灰固体的试管加热,可制取并收集到干燥的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用硫酸厂废渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式可表示为[Fe2(OH)n(SO4)3-0.5n]m,主要工艺流程如下:
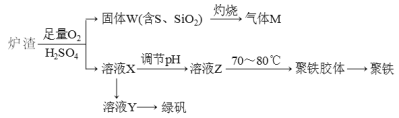
下列说法错误的是
A.炉渣中FeS与稀硫酸和氧气反应的离子方程式为:4FeS+3O2+12H+=4Fe3++4S↓+6H2O
B.气体M的成分是SO2,通入H2O2溶液得到硫酸,可循环使用
C.向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸干即得绿矾
D.溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、硫单质及其化合物性质是一个重要的课题。回答下列问题:
(1)恒容密闭容器中,工业固氮:N2(g)+3H2(g) ![]() 2NH3(g)的平衡常数K值和温度关系如表:
2NH3(g)的平衡常数K值和温度关系如表:
温度/℃ | 25 | 200 | 300 | 400 | 450 |
K | 5108 | 1.0 | 0.86 | 0.507 | 0.152 |
①从上表列出数据分析,该反应为__________反应(填:“吸热”或“放热”)。
②有关工业合成氨的研究成果,曾于1918年、1931年、2007年三次荣膺诺贝尔奖。下列关于关于合成氨反应描述的图像中,不正确的是_________(填:字母选项)。
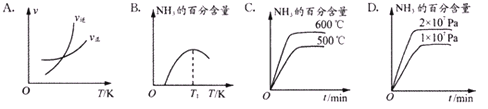
③450℃时,测得某时刻氨气、氮气、氢气物质的量浓度分别为3mol/L、2mol/L、1mol/L时,该反应的v(正)____________v(逆)(填“>”、“=”或“<”)。
(2)近年,科学家又提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g),则其反应热ΔH=___________________。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热ΔH=___________________。(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1 2H2(g) +O2(g)
2NH3(g) △H=-92.4kJ·mol-1 2H2(g) +O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )
(3)联氨(N2H4)、二氧化氮(NO2)可与KOH溶液构成碱性燃料电池,其电池反应原理为2N2H4 +2NO2 = 3N2+8H2O。则负极的电极反应式为__________________________。
(4)部分金属硫化物的溶度积常数(Ksp)如下表:
硫化物 | CuS | ZnS | MnS | FeS |
Ksp | 6.3×10-36 | 2.9×10-25 | 2.5×10-13 | 6.3×10-18 |
由列表数据分析推知,向含有Cu2+、Zn2+、Mn2+、Fe2+的工业废水中加入MnS粉末的作用是_____________________________________。
(5)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =_______。
PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除![]() 外,还有( )
外,还有( )
A. 7种 B. 11种 C. 14种 D. 17种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝鞣剂主要成分为Al(OH)2Cl,主要用于揉制皮革。利用铝灰(主要成分为Al、Al2O3、AlN,FeO等)制备铝鞣剂的一种工艺如图所示:
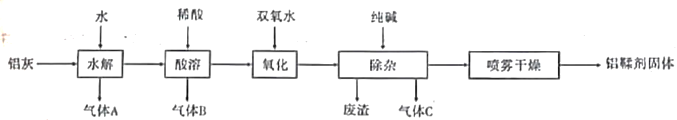
请回答下列问题:
(1)气体A、气体C的分子式为_________、______________
(2)产生气体B的化学方程式为:________________________________________________
(3)氧化时,发生反应的离子方程式为:__________________________________________
(4)废渣的主要成分为__________________(填化学式)。
(5)某同学设计如下方案测定铝鞣剂样品中Al(OH)2Cl质量分数。
操作Ⅰ:准确称取所制备的铝鞣剂m g放入烧杯中。
操作Ⅱ:加入_____________(填试剂名称),并用玻璃棒搅拌至固体全部溶解。
操作Ⅲ:加入足量___________(填化学式)溶液,充分反应,过滤、_________、__________得固体n g。根据所测数据即可计算出样品中Al(OH)2Cl质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是( )
A. CH3Cl+Cl2 → CH2Cl2 + HCl
B. CH2=CH2+HO﹣H → HOCH2﹣CH3
C. 2CH3CH2OH+O2![]() 2CH3CHO + 2H2O
2CH3CHO + 2H2O
D. ![]() +Br2
+Br2![]()
![]() + HBr
+ HBr
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com