
【题目】H5IO6(正高碘酸)是用于光度法测定苯肼的试剂。工业上用NaIO3制备H5IO6的流程如图:
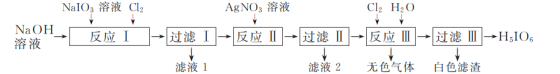
(1)“反应Ⅰ”可在如图所示的装置中进行。该反应生成不溶于水的Na2H3IO6的离子方程式为____。若要提高Cl2的利用率,可对装置进行改进的措施为___。
(2)反应Ⅱ生成不溶于水的黑色Ag5IO6,“滤液2”呈__(填“酸”“碱”或“中”)性。
(3)“无色气体”为__(填化学式)。
(4)工业上为降低成本,减少对环境的污染,整个流程需要控制加入Cl2和AgNO3的物质的量之比为n(Cl2)∶n(AgNO3)=__。
(5)H5IO6具有强氧化性,可将FeSO4氧化为H2FeO4,自身被还原为HIO3,该反应的化学方程式为___。
【答案】IO3-+Cl2+2Na++3OH-=Na2H3IO6↓+2Cl- 通Cl2导管的下端连接多孔球泡装置 酸 O2 7∶10 FeSO4+2H5IO6=H2FeO4+H2SO4+2HIO3
【解析】
反应Ⅰ是在氢氧化钠溶液中将碘酸钠氧化为不溶于水的Na2H3IO6,过滤得到Na2H3IO6,反应Ⅱ加入硝酸银溶液生成不溶于水的黑色Ag5IO6,过滤得到黑色Ag5IO6,反应Ⅲ加入氯气和水反应的化学方程式为:2Ag5IO6+5Cl2+H2O=10AgCl↓+5O2+2H5IO6,生成气体氧气,过滤得到H5IO6(正高碘酸)。
(1)氢氧化钠溶液中氯气将碘酸钠氧化为不溶于水的Na2H3IO6,反应的化学方程式为:NaIO3+Cl2+3NaOH=Na2H3IO6↓+2NaCl,该反应生成不溶于水的Na2H3IO6的离子方程式为IO3-+Cl2+2Na++3OH-=Na2H3IO6↓+2Cl-。若要提高Cl2的利用率,可对装置进行改进的措施为:通Cl2导管的下端连接多孔球泡装置。
故答案为:IO3-+Cl2+2Na++3OH-=Na2H3IO6↓+2Cl-;通Cl2导管的下端连接多孔球泡装置;
(2)反应Ⅱ加入硝酸银反应生成不溶于水的黑色Ag5IO6,反应为:Na2H3IO6+5AgNO3=3HNO3+2NaNO3+Ag5IO6↓,滤液中生成硝酸,溶液显酸性;
故答案为:酸 ;
(3)上述分析可知Ag5IO6被氧化生成高碘酸,反应的化学方程式为:2Ag5IO6+5Cl2+H2O=10AgCl↓+5O2+2H5IO6,“无色气体”为O2 (填化学式)。
故答案为:O2 ;
(4)依据化学反应的定量关系计算:NaIO3+Cl2+3NaOH=Na2H3IO6+2NaCl,Na2H3IO6+5AgNO3=3HNO3+2NaNO3+Ag5IO6↓,2Ag5IO6+5Cl2+H2O=10AgCl↓+5O2+2H5IO6,计算得到,2Cl2~2Na2H3IO6~10AgNO3~2Ag5IO6~5Cl2,所以整个流程需要控制加入氯气和硝酸银的物质的量之比为n(Cl2)∶n(AgNO3)=7∶10。
故答案为:7∶10;
(5)H5IO6具有强氧化性,可将FeSO4氧化为H2FeO4,自身被还原为HIO3,该反应的化学方程式为FeSO4+2H5IO6=H2FeO4+H2SO4+2HIO3。
故答案为:FeSO4+2H5IO6=H2FeO4+H2SO4+2HIO3。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工医药材料等领域有广泛的应用。回答下列问题:
(1)基态K原子中,核外运动状态不同的电子共________种,占据最高能级的电子的电子云轮廓图形状为________。
(2)K和Cr属于同一周期,且核外最外层电子构型相同。第一电离能比较:K________(填“>”或“<”)Cr,金属键强度比较:K________(填“>”或“<")Cr.
(3)IO3-离子的立体构型的名称为________,中心原子的杂化方式为________.
(4)HIO4的酸性强于HIO3,其原因为________
(5)KIO3晶体是一种性能良好的非线性光学材料,晶胞如图。
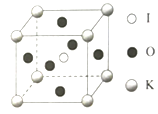
晶胞的棱长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与I间的最短距离为________nm,与K紧邻的O的个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5 mL 0.005 mol·L-1的FeCl3溶液与5 mL0.01 mol·L-1的KSCN溶液混合,建立平衡:FeCl3+3KSCN![]() 3KCl+Fe(SCN)3(红色)。
3KCl+Fe(SCN)3(红色)。
(1)若滴加饱和FeCl3溶液4滴,平衡向________方向移动,溶液红色________。
(2)若滴加1 mol·L-1KSCN溶液4滴,平衡向________方向移动,溶液红色________。
(3)若滴加0.01 mol·L-1NaOH溶液4滴,则产生____ (填颜色)沉淀,c(Fe3+)___,平衡向______方向移动,溶液红色________。
(4)若加入少量KCl固体,则平衡________移动,原因________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在古代,我国人民就积累了不少对化学物质变化的认识。例如,晋代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这句话中的丹砂指的是HgS,下列有关说法正确的是( )
A.这个过程只涉及物理变化
B.“积变又还成丹砂”过程中发生反应:HgS![]() Hg+S
Hg+S
C.实验室中不慎洒落的水银不能用硫黄处理
D.“丹砂烧之成水银”过程中还可能产生SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是( )
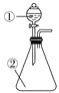
A. 若②为浓盐酸;产生大量气体产生;说明硫酸的酸性比盐酸强
B. 若②为铜片;有气泡产生,底部生成灰白色固体;说明浓硫酸有强氧化性
C. 若②为蓝色硫酸铜晶体;蓝色晶体变为白色;说明浓硫酸有吸水性,发生物理变化
D. 若②为蔗糖;白色固体变为黑色海绵状,有气体放出;说明浓硫酸有脱水性、氧化性
【答案】D
【解析】
A.浓硫酸具有吸水性,浓盐酸具有挥发性,浓硫酸吸收浓盐酸中的水分导致浓盐酸浓度增大而加强其挥发性,浓硫酸和盐酸都是强酸,该实验体现浓盐酸的挥发性和浓硫酸的吸水性,故A错误。
B.常温下浓硫酸和Cu不反应,所以没有明显现象,故B错误。
C.浓硫酸具有吸水性,能吸收五水硫酸铜中的结晶水而使五水硫酸铜变为无水硫酸铜,固体由蓝色变为白色,该实验为化学变化,故C错误。
D.浓硫酸能将有机物中的H、0元素以2:1水的形式脱去而体现脱水性,还能将蔗糖脱水后形成的碳单质. 氧化为二氧化碳.同时还生成刺激性气味的二氧化硫,体现了浓硫酸的强氧化性.故D正确。
答案选D。
【题型】单选题
【结束】
9
【题目】已知NH4NO3在空气中爆炸时的反应为4NH4NO3![]() 3N2↑+2NO2↑+8H2O↑。下列说法不正确的是( )
3N2↑+2NO2↑+8H2O↑。下列说法不正确的是( )
A.NH4NO3在高温下爆炸时可以看到红棕色的烟雾
B.NH4NO3的含氮量小于氯化铵
C.实验室不能用NH4NO3固体与Ca(OH)2固体混合加热制备NH3
D.乘坐火车时不能携带NH4NO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室测定铬铁矿中铬(Cr)含量的步骤如下:
步骤1:准确称取0.2000g铬铁矿试样放入锥形瓶中,加入适量磷酸和硫酸的混合酸,加热使试样完全溶解,冷却。
步骤2:向上述溶液中滴加5滴1%MnSO4溶液,再加入一定量的(NH4)2S2O8溶液,摇匀至溶液呈紫红色[先后发生Cr3+![]() Cr2O72-、Mn2+
Cr2O72-、Mn2+![]() MnO4-]。
MnO4-]。
步骤3:上述溶液加热煮沸至紫红色褪去[除去过量的(NH4)2S2O8和生成的MnO4-],冷却。
步骤4:用0.2000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定上述溶液至终点(发生Cr2O72-![]() Cr3+),消耗19.50mL标准溶液。
Cr3+),消耗19.50mL标准溶液。
(1)(NH4)2S2O8中阴离子的结构如图所示。从结构分析,(NH4)2S2O8置于棕色试剂瓶并于阴凉处保存的原因是__。
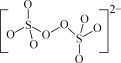
(2)“步骤2”中加入5滴1%MnSO4溶液的目的是__。
(3)“步骤3”中,如果继续加热煮沸时间不充足,会使铬含量的测定结果___(填“偏大”“不变”或“偏小”)。
(4)计算铬铁矿中铬的质量分数___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从八角茴香中提取的莽草酸,是合成治疗禽流感的药物——达菲( Tamiflu) 的原料之一。其结构简式如图,下列有关莽草酸分子的说法正确的是
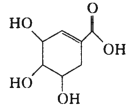
A.含有两种不同的官能团
B.7个碳原子共面
C.1mol能与4molNaOH 完全反应
D.既能使 Br2的CCl4溶液褪色 ,又能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用 0.1molL-1NaOH溶液滴定 20 mL 0.1 molL-1 某二元弱酸 H2A ( Ka1 =1.1×10-3,Ka2= 3.9×10-6 )溶液,滴定过程中溶液的 pH 变化曲线如图所示。下列说法正确的是
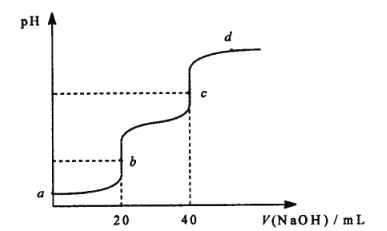
A.a 点的pH 大于2
B.b 点溶液中c(H2A) > c(A2-)
C.c 点溶液中c( HA-) + 2c(H2A ) = c( OH- )-c(H+)
D.d 点溶液中c (Na+) +c(H+) =c(A2-) +c(HA-) +c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A. 1 L 1 mol/L的Na2CO3溶液中含有的CO32-数目为![]()
B. 常温常压下,8 g O2含有的电子数是4NA
C. 标准状况下,2.24 L CCl4中含有的分子数为0.1NA
D. 25℃时,1 L pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com