
�״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ��͢���CH4��H2OΪԭ�����Ʊ��״���
CH4(g)+H2O(g) CO(g)+3H2(g)������ CO(g)+2H2(g)
CO(g)+3H2(g)������ CO(g)+2H2(g) CH3OH(g)
������
CH3OH(g)
������
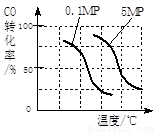
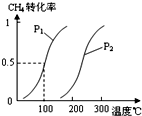
��1����1.0 mol CH4��2.0 mol H2O(g)ͨ���ݻ�Ϊ100L��Ӧ�ң���һ�������·�����ӦI��CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��

����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����Ϊ ��
��ͼ�е�P1 P2���<������>����=������100��ʱƽ�ⳣ����ֵΪ ��
��2����ѹǿΪ0.1 MPa������, ��a mol CO�� 3a mol H2�Ļ�������ڴ��������£��Է���Ӧ�����ɼ״���
�۸÷�Ӧ�ġ�H 0���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ��� ��
A�������¶� B����CH3OH(g)����ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D���ٳ���1mol CO��3mol H2
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�
|
ʵ���� |
T(��) |
n(CO)/n(H2) |
P��Mpa�� |
|
i |
150 |
1/3 |
0.1 |
|
ii |
|
|
5 |
|
iii |
350 |
|
5 |
a�������ϱ��ո�������ʣ���ʵ���������ݡ�
b�����ݷ�Ӧ����ص㣬�ڸ���������ͼ�У���������5MPa������CO��ת�������¶ȱ仯����������ʾ��ͼ��������ѹǿ��

����16�֣�
��1����7�֣���0.003mol/��L��min����2�֣� ��<��2�֣� 2.25��10��4��3�֣�
��2����9�֣���<��2�֣� BD��2�֣�
��a�������±���3�֣�
|
ʵ���� |
T���棩 |
n��CO��/n��H2�� |
P��Mpa�� |
|
i |
|
|
|
|
ii |
150 |
1/3 |
|
|
iii |
|
1/3 |
|
b��������ͼ��2�֣�
��������
�����������1������ʼʱc(CH4)=1.0mol/100L=0.01mol/L����ͼ��֪ƽ��ʱCH4ת����Ϊ0.5����CH4�ı仯Ũ��Ϊ0.01mol/L��0.5=0.005mol/L�����ݻ�ѧ��Ӧ���ʼ��㹫ʽ��֪��v(CH4)= 0.005mol/L��5min=0.001mol/(L•min)������ϵ��֮�ȵ�������֮�ȿ�֪��v(H2)=3 v(CH4)= 0.003mol/(L•min)����I����̬�����������ķ�Ӧ���������ѹǿƽ�����ƣ�CH4ת���ʼ�С����Сѹǿƽ�����ƣ�CH4ת��������ѹǿԽС��CH4ת����Խ��ͼ��֪��200�桢P1ʱCH4ת���ʴ���200�桢P2ʱCH4ת���ʣ�˵��P1< P2����P1��100��ʱ��
CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
��ʼŨ��/ mol��L��1 0.01 0.02 0 0
�仯Ũ��/ mol��L��1 0.005 0.005 0.005 0.015
ƽ��Ũ��/ mol��L��1 0.005 0.015 0.005 0.015
K=[ c(CO)•c3(H2)]/[ c(CH4)•c(H2O)]= [0.005��0.0153]/[ 0.005��0.015]=2.25��10��4
��2����II����̬���������С�ķ�Ӧ������������ԭ����������Ӧ�������оݣ���H<0������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����ƣ��״����ʼ�С����A����С������Ũ�ȣ�ƽ�����ƣ��״���������B��ȷ������������壬��Ȼ����ѹǿ�����������ݻ����䣬�����Ũ�Ȳ��䣬ƽ�ⲻ�ƶ����״����ʲ��䣬��C�����ٳ���Ͷ�ϱ���ͬ��CO��H2����������ѹǿ��ʹƽ�����ƣ��״���������D��ȷ����a�����ݿ��Ʊ���̽����ԭ��ʵ��i��ii��ѹǿ��ͬ�����¶Ⱥ�Ͷ�ϱ�һ����ͬ��ʵ��ii��iii���¶Ȳ�ͬ����Ͷ�ϱȺ�ѹǿһ����ͬ���ɴ�ȷ��ʵ��ii���¶�Ϊ150�棬Ͷ�ϱ�Ϊ1/3��ʵ��iii��Ͷ�ϱ�Ϊ1/3��b����ͼҪ�㣺��ͬ�¶��£�����ѹǿƽ�����ƣ�COת����������0.1MPaʱCOת�������¶ȱ仯���������ʵ�ƽ�ƣ��ͱ�Ϊ5MPaʱCOת�������¶ȱ仯���ߡ�
���㣺���黯ѧ��Ӧԭ�����漰��ѧ��Ӧ���ʵļ��㡢ѹǿ�Ի�ѧƽ���Ӱ�졢��ѧƽ�ⳣ���ļ��㡢��Ӧ�ȵ���������߲��ʵĴ�ʩ��̽��ʵ�鷽������ơ���ͼ�ȳ������鷽ʽ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ�ٺͷ�Ӧ�ڣ���CH4��H2OΪԭ�����Ʊ��״���CH3OH����
�״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ�ٺͷ�Ӧ�ڣ���CH4��H2OΪԭ�����Ʊ��״���CH3OH����| ʵ���� | T���棩 | n ��CO��/n��H2�� | P��MPa�� | ||
| I | 150 |
|
0.1 | ||
| II | 5 | ||||
| III | 350 | 5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ��͢���CH4��H2OΪԭ�����Ʊ��״���
��1����1��0 mol CH4��2��0 mol H2O��g��ͨ�뷴Ӧ�ң��ݻ�Ϊ100L������һ�������·�����Ӧ��
CH4��g��+H2O��g��CO��g��+3H2��g��������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min,
������H2��ʾ��ƽ����Ӧ����Ϊ_ ��ͼ�е�P1_ _P2���<������>����=������
100��ʱƽ�ⳣ��Ϊ_ _��
����������������ʱ�����¶ȣ��淴Ӧ���ʽ�_ _������� ����С�����䡱����
��2����ѹǿΪ0��1 MPa������, ��a mol CO�� 3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO��g��+2H2��g�� CH3OH��g�� ������
�ܸ÷�Ӧ�ġ�H_ _0����S_ _0���<������>����=������
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���_ _��
A�������¶�
B����CH3OH��g������ϵ�з������
C������He��ʹ��ϵ��ѹǿ����
D���ٳ���1mol CO��3molH2
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ƶı��С�
| l ʵ���� | l T���棩 | l n ��CO��/n��H2�� | l P��MP�� |
| l �� | l 150 | l 1/3 | l 0��1 |
| l �� | l __ | l __ | l 5 |
| l �� | l 350 | l __ | l 5 |
A�������ϱ��ո�������ʣ���ʵ���������ݡ�
B�����ݷ�Ӧ����ص㣬�ڸ���������ͼ�У���������0��1MPa��5MPa������CO��ת�������¶ȱ仯����������ʾ��ͼ���������������ߵ�ѹǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��ӱ�ʡ������ѧ�߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
��14�֣��״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ��͢���CH4��H2OΪԭ�����Ʊ��״���
(1)��1 mol CH4��2 mol H2O(g)ͨ�뷴Ӧ�ң��ݻ�Ϊ100L��������һ�������·������·�Ӧ��CH4(g)+H2O(g) CO(g)+3H2(g)������
CO(g)+3H2(g)������
���CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��
�ٵ�ѹǿΪP1���¶�Ϊ100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ0��5min�ڵ�ƽ����Ӧ����Ϊ______��
��ͼ�е�P1_________P2���<������>����������
��100��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ______________��
����������������ʱ�����¶ȣ���Ӧ����淴Ӧ���ʽ�________(����� ����С�����䡱)����Ӧ_________�ƶ�����������������淽��������
��2����ѹǿΪ0.1 MPa������, ��a mol CO�� 3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״����䷴Ӧ���£�CO(g)+2H2(g) CH3OH(g)������
CH3OH(g)������
����÷�Ӧ�ġ�H________0����S_________0(�<������>������)��
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���___________��
A�������¶� B����CH3OH(g)����ϵ�з��� C������He��ʹ��ϵ��ѹǿ����
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ƶı��С������±��ո�������ʣ���ʵ���������ݡ�
| ʵ���� | T(��) | n (CO)/n(H2) | P(MPa) |
| �� | 150 | 1/3 | 0.1 |
| �� | | | 5 |
| �� | 350 | | 5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�꼪��ʡ����ʦ���и��������ģ�⿼�ԣ������ۺϣ���ѧ���� ���ͣ������
��14�֣�
�״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ��͢����Ʊ��״���
��1����1��0 mol CH4��2��0 mol H2O��g��ͨ�뷴Ӧ�ң��ݻ�Ϊ100L������һ�������·�����Ӧ��CH4��g��+H2O��g�� CO��g��+3H2��g��������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
CO��g��+3H2��g��������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����Ϊ ��
��ͼ�е�P1 P2���<������>����=������100��ʱƽ�ⳣ��Ϊ ��
��2����ѹǿΪ0��1 MPa������, a mol CO�� 3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO��g��+2H2��g�� CH3OH��g�� ������
CH3OH��g�� ������
�۸÷�Ӧ�ġ�H 0����S 0���<������>����=������
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���
| A�������¶� | B����CH3OH��g������ϵ�з��� |
| C������He��ʹ��ϵ��ѹǿ���� | D���ٳ���1mol CO��3mol H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�꼪��ʡ���������ģ�⿼�ԣ������ۺϣ���ѧ���� ���ͣ������
��14�֣�
�״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ��͢����Ʊ��״���
��1����1��0 mol CH4��2��0 mol H2O��g��ͨ�뷴Ӧ�ң��ݻ�Ϊ100L������һ�������·�����Ӧ��CH4��g��+H2O��g�� CO��g��+3H2��g��������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
CO��g��+3H2��g��������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����Ϊ ��
��ͼ�е�P1 P2���<������>����=������100��ʱƽ�ⳣ��Ϊ ��

��2����ѹǿΪ0��1 MPa������, a mol CO�� 3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO��g��+2H2��g��  CH3OH��g�� ������
CH3OH��g�� ������
�۸÷�Ӧ�ġ�H 0����S 0���<������>����=������
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���
A�������¶� B����CH3OH��g������ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D���ٳ���1mol CO��3mol H2
��3�������¿�����Ͷ�����������������ֱ�Ӽ״�ȼ�ϵ���У���������������ʹ�ã������ȼ�ϵ��Ч��Լ30%���õ�صĸ�����ӦΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com