
| A.酸性:HCOOH>HCl |
| B.热稳定性:NaHCO3>Na2CO3 |
| C.非金属性:F>S |
| D.离子半径:Na+>Cl- |
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:不详 题型:单选题
| A.所有的非金属元素都分布在p区 |
| B.元素周期表中ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
| C.稀有气体原子的最外层电子数都是8 |
| D.同一元素的各种同位素的物理性质、化学性质均相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 电离能/(kJ?mol-1) | I1 | I2 | I3 | I4 | I5 |
| Y | 584 | 1823 | 2751 | 11584 | 14837 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径大小:Na>S>O |
| B.金属性强弱:K>Na>Ca |
| C.酸性强弱:HIO4>HBrO4>HClO4 |
| D.碱性强弱:LiOH>NaOH>KOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性H4SiO4<H3PO4<H2SO4<HClO4 |
| B.碱性Ca(OH)2>Mg(OH)2>Al(OH)3 |
| C.稳定性SiH4>NH3>H2O>HF |
| D.半径O2->F->Mg2+>Al3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
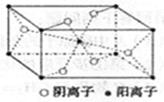
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
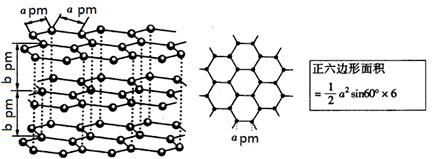
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com