
短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则叙述正确的是
A.原子半径A>B>D>C B.原子序数d>c>b>a
C.离子半径C>D>B>A D.单质的还原性A>B>D>C
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
| 元素编号 | a | b | c | d | e | f | g | h | i | j |
| 原子半径/pm | 111 | 77 | 70 | 104 | 143 | 99 | 117 | 186 | 160 | 64 |
| 最高化合价或 最低化合价 |
+2 | -4 | -3 | +6 | +3 | -1 | +4 | +1 | +2 | -1 |
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | a a |
b b |
c c |
j j |
||||
| 3 | h h |
i i |
e e |
g g |
d d |
f f |
||
| ||
| ||
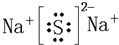
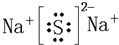


查看答案和解析>>
科目:高中化学 来源: 题型:

| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 589 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、25℃时,bB3+、dD-在
| ||||
| B、在AD溶液中存在:D-+H2O?HD+OH-,故其溶液呈碱性 | ||||
| C、离子半径:cC2->dD->bB3+>aA+ | ||||
D、电解AD水溶液的化学方程式为:2AD+2H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com