
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | ① | ② | ③ |
| 平衡移动方向 | ④ | ⑤ | ⑥ |
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | ①减小 | ②减小 | ③增大 |
| 平衡移动方向 | ④逆向 | ⑤正向 | ⑥逆向 |
| Ksp |
| c2(OH-) |
| 1.8×10-11 |
| (10-10)2 |


科目:高中化学 来源: 题型:
| A、含有离子键的化合物一定是离子化合物 |
| B、含有共价键的化合物一定是共价化合物 |
| C、共价键一定使原子结合成共价化合物 |
| D、离子键可分为极性键和非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
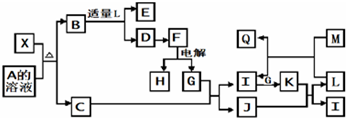
查看答案和解析>>
科目:高中化学 来源: 题型:

| 优 点 | 缺 点 | |
| 甲装置 | ||
| 乙装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | 与Mg同周期,最外层电子数是最内层电子数的3倍 |
| Y | 常温下单质为双原子分子,为黄绿色有毒气体 |
| Z | 单质紫黑色,遇淀粉溶液显蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤、石油、天然气等是化石燃料 |
| B、氢氧化钡晶体与氯化铵晶体的反应是放热反应 |
| C、直接燃烧煤比将煤进行处理转化为气体或液体燃料再燃烧效果好 |
| D、酸与碱发生中和反应时放出的热量叫中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、15.6g Na2O2晶体中含有的离子总数为0.6NA |
| B、标准状况下,22.4L CCl4中含有的C原子数目为NA |
| C、1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| D、铝与足量氢氧化钠溶液充分作用生成6.72 L H2,反应掉的铝原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、MnO4-、Cl-、SO42- |
| B、Na+、AlO2-、NO3-、CO32- |
| C、Na+、H+、NO3-、Cl- |
| D、Na+、SO42-、HCO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com