
科目:高中化学 来源: 题型:选择题
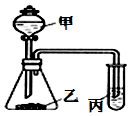 利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是( )
利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是( )| 选项 | 甲 | 乙 | 丙 | 装置丙中的现象 | 实验结论 |
| A | 稀硝酸 | 碳酸钾 | 澄淸石灰水 | 变浑浊 | 酸性:HNO3>H2CO3 |
| B | 稀硫酸 | 碳酸钠 | 次氯酸钙溶液 | 白色沉淀 | 酸性:H2CO3>HClO |
| C | 浓盐酸 | 大理石 | 硅酸钠溶液 | 白色沉淀 | 非金属性:C>Si |
| D | 浓盐酸 | 高锰酸钾 | 石蕊溶液 | 先变红后褪色 | 氯水既有酸性,又具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 甲 | 乙 | 丙 | 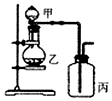 |
| A | 证明浓硫酸具有强氧化性 | 浓硫酸 | 碳粉 | 溴水 | |
| B | 验证Cl2无漂白性 | 浓盐酸 | MnO2 | 干燥的红色布条 | |
| C | 验证NH3溶于水显碱性 | 浓氨水 | 碱石灰 | 湿润的蓝色石蕊试纸 | |
| D | 比较H2CO3和H2SiO3的酸性 | 硼酸溶液 | 碳酸钠 | 硅酸钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素B的化合物可以用来做焰火材料 | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 元素B、D的最高价氧化物对应的水化物之间可能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .己知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键.
.己知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
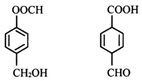
| A. | 均可发生取代、加成反应 | |
| B. | 均能使酸性高锰酸钾溶液褪色 | |
| C. | 分子中共平面的碳原子数相同 | |
| D. | 互为同分异构体,可用NaHCO3溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 将硫的酒精溶液滴入一定量的热水中得微蓝色透明液体,用激光笔照射微蓝色透明液体,有光亮的通路 | 微蓝色透明液体为胶体 |
| B | 室温下,向10mL 0.2mol•L-1 AgNO3溶液中滴入2滴0.1 mol•L-1 NaCl溶液,产生白色沉淀后,再滴加2滴0.1mol•L-1NaI溶液,生成黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向某溶液中加入BaCl2溶液,无明显现象,再加稀盐酸,有无色且能使澄清石灰水变浑浊的气体产生 | 溶液中一定含HCO3- |
| D | 取少量CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液,无淡黄色沉淀出现 | CH3CH2Br没有水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
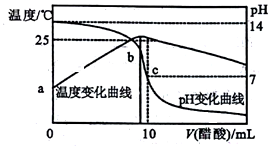 在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )| A. | 水的电离程度:c>b | B. | a点Kw比b点大 | ||
| C. | n>1.0 | D. | c点:Ka(CH3COOH)=$\frac{10}{10n+1}$×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
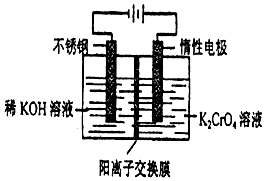 以10L 0.1mol/L铬酸钾(K2CrO4)溶液为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图如下,下列说法不正确的是( )
以10L 0.1mol/L铬酸钾(K2CrO4)溶液为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图如下,下列说法不正确的是( )| A. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| B. | 在阴极室,通电后KOH溶液不断变浓,并产生气体H2 | |
| C. | CrO42-通过离子交换膜从阳极区域迁移到阴极区域 | |
| D. | 电解一段时间后测定阳极液中K和Cr的物质的量之比为d,则导线中转移电子的物质的量为(2-d)mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com