
���� ��1��1molCH4�к���4mol����ԭ�ӣ�����N=nNA��ͬ��ͬѹ�£�ͬ�����NH3��H2S�������ʵ�����ȣ�����m=nM���м�����⣻����n=$\frac{m}{M}$������⣻
��2������n=$\frac{m}{M}$����CO���ʵ�����15��������CO������Ŀ��ȣ���������ʵ�����ȣ��ٸ���M=$\frac{m}{n}$���������Ħ��������
��3������n=$\frac{m}{M}$����m gFe3+�����ʵ������ٸ���c=$\frac{n}{V}$�������Һ��Fe3+�����ʵ���Ũ�ȣ���Fe3+�غ��֪��c[Fe2��SO4��3]=$\frac{1}{2}$c��Fe3+����
��4��ȼ�յ������ǣ������ʾ��п�ȼ�ԣ��ڿ�ȼ���������Ӵ������¶ȴﵽ��ȼ����Ż�㣬����ȼ��ȼ�յ������������������ƺ�ˮ��Ӧ�����������ƺ�������
��� �⣺��1��1molCH4�к���4mol����ԭ�ӣ�8g CH4�����ʵ���Ϊ��$\frac{8g}{16g/mol}$=0.5mol��������ԭ�ӵ����ʵ�����0.5��4=2mol������N=nNA=0.1��4NA=0.4NA��ͬ��ͬѹ�£�ͬ�����NH3��H2S�������ʵ�����ȣ���������֮��Ϊ��17��34=1��2�����֮�ȵ������ʵ���֮�ȣ�$\frac{1}{17}��\frac{1}{34}$=2��1���ʴ�Ϊ��2��0.4NA��1��2��2��1��
��2��11.2L CO�����ʵ���=$\frac{11.2L}{22.4L/mol}$=0.5mol��15��������CO������Ŀ��ȣ���������ʵ�����ȣ��ʸ�����Ħ������=$\frac{15g}{0.5mol}$=30g/mol��
�ʴ�Ϊ��30g/mol��
��3��m gFe3+�����ʵ���Ϊ$\frac{mg}{56g/mol}$=$\frac{m}{56}$mol�������Һ��Fe3+�����ʵ���Ũ��Ϊ$\frac{\frac{m}{56}}{V}$=$\frac{m}{56V}$mol/L��
��Fe3+�غ��֪��c[Fe2��SO4��3]=$\frac{1}{2}$c��Fe3+��=$\frac{1}{2}$��$\frac{m}{56V}$mol/L=$\frac{m}{112V}$mol/L��
�ʴ�Ϊ��$\frac{m}{56V}$��$\frac{m}{112V}$��
��4����֬��ȼ����Ҫ���������¶ȴﵽ�Ż�㣬˵������������ˮ��Ӧ�����������ɣ�ͬʱ�����������ȣ��÷�ӦΪ���ȷ�Ӧ���������ƺ�ˮ��Ӧ�����������ƺ�����������ʽΪ2Na2O2+2H2O=4NaOH+O2�����ʴ�Ϊ���÷�Ӧ�Ƿ��ȷ�Ӧ��2Na2O2+2H2O=4NaOH+O2����
���� ���⿼�����ʵ���Ũ�ȵ��йؼ��㣬�Ƚϻ�����ע��Թ�ʽ������������ã�ע������Ũ������Ӧ����Ũ�ȵĹ�ϵ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ�������� | B�� | �ܼ����������仯 | ||
| C�� | ��ҺΪ������Һ��Ũ�Ȳ��� | D�� | �о����������ܼ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Na��ˮ��Ӧ��Na+H2O�TNa++OH-+H2�� | |
| B�� | ����Ca��HCO3��2��Һ��NaOH��Һ��Ӧ��Ca2++HCO3-+OH-�TCaCO3��+H2O | |
| C�� | ʯ��ʯ����ϡ���CaCO3+2H+�TCa2++H2O+CO2�� | |
| D�� | ��������ͭ��Һ��Ӧ��2Fe+3Cu2+�T2Fe3++3Cu |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
| Ũ��/mol•L-1 | 4��10-6 | 6��10-6 | 2��10-5 | a | 4��10-5 | 3��10-5 | 2��10-5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ɫ | B�� | ��ɺ�ɫ | C�� | ����ɫ���� | D�� | �ȱ�����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Һ��ͨ��SO2��Ca2++2ClO-+H2O+SO2�TCaSO3��+2HClO | |
| B�� | ����������Һ�еμ���������ֱ�������������3Ba2++6OH-+2Al3++3SO42-�T3BaSO4��+2Al��OH��3�� | |
| C�� | ���⻯�Ʒ������룺HS-+H2O�TH3O++S2- | |
| D�� | ��ʳ���������е�Ħ����̼��ƣ�CaCO3+2H+�TCa2++H2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol/LNa2S2O3��H2SO4��5mL����ˮ5mL����Ӧ�¶�10�� | |
| B�� | 0.1mol/LNa2S2O3��H2SO4��5mL����ˮ10mL����Ӧ�¶�10�� | |
| C�� | 0.1mol/LNa2S2O3��H2SO4��5mL����ˮ5mL����Ӧ�¶�30�� | |
| D�� | 0.2mol/LNa2S2O3��H2SO4��5mL����ˮ10mL����Ӧ�¶�30�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4 L CCl4�ķ�����ԼΪNA�� | |
| B�� | ���³�ѹ�£�3.2gO2��O3��������к��е���ԭ����ĿΪ0.2NA | |
| C�� | ��״���£�0.1molCl2����ˮ��ת�Ƶĵ�����ĿΪ0.1NA | |
| D�� | ���¸�ѹ�£�28gN2��6gH2��Ӧ�����ɵ�NH3������Ϊ2nA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
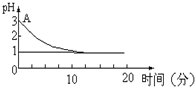 ���ڡ�����Ȼ�ͭ��Һʱ��pHֵ�仯�����⣬��ѧ�����������ֲ�ͬ�Ĺ۵㣺
���ڡ�����Ȼ�ͭ��Һʱ��pHֵ�仯�����⣬��ѧ�����������ֲ�ͬ�Ĺ۵㣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com