
实验室模拟合成氨和氨催化氧化的流程如下:
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
(1)从下图中选择制取气体的合适装置
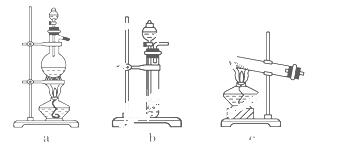
氮气____________、 氢气______________.
氢气______________.
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有__________、____________.
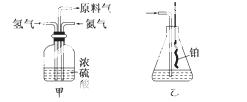
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,______(填“会”或“不会”)发生倒吸,原因是__________________________________________________________________________。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是____________________,锥形瓶中还可观察到的现象是______________。
(5)写出乙装置中氨氧化的化学方程式:___________________________________________。
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、__________、__________.
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
上图为元素周期表截取的短周期的一部分,即 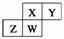 。 四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( )
。 四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( )
A.原子半径:W>Z>Y>X
B.气态氢化物 的稳定性:Z>W>X>Y
的稳定性:Z>W>X>Y
C.W的最高正化合价与负化合价的绝对值可能相等
D.Z的最高价氧化物的水化物可能为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组借助右图装置完成收集NO气体的实验。
正确的操作是( )
A.从①口进气,用排水法集气
B.从①口进气,用排气法集气
C.从②口进气,用排水法集气
D.从②口进气,用排气法集气
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家预测,氨有望取代氢能,成为重要的新一代绿色能源。下列有关说法不正确的是
A.液氨作为清洁能源的反应原理是4NH3+5O2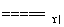 4NO+6H2O
4NO+6H2O
B.液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏
C.氨气比空气轻,标准状况下密度约为0.76 g·L-1
D.氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废气中的氮氧化物(如NO、NO2等 ,用通式NOx表示)是主要的大气污染物之一.为了保护环境,
,用通式NOx表示)是主要的大气污染物之一.为了保护环境,
工业上常通入氨气与之发生如下反应:NOx+NH3—→N2+H2O来消除污染.有关此反应,下列说法中错误
的是 ( )
A.N2既是氧化产物又 是还原产物
是还原产物
B.当x=1时,每生成2.5 mol N2,被氧化的气体有3 mol
C.当x=2时,有1 mol气体被还原,转移电子4 mol
D.反应通式配平表示为:6NOx+4xNH3===(3+2x)N2+6xH2O
查看答案和解析>>
科目:高中化学 来源: 题型:
(NH4)2SO4在一定条件下发生如下反应:4(NH 4)2SO4 =N2↑+6NH3↑+3SO2↑+SO3↑+7H2O;将反应后的混合气体通入BaCl2溶液,产生的沉淀为
4)2SO4 =N2↑+6NH3↑+3SO2↑+SO3↑+7H2O;将反应后的混合气体通入BaCl2溶液,产生的沉淀为
A.BaSO4 B.BaSO3 C.BaS D.BaSO4和BaSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式。
该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,计算推进剂中联氨的质量。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为:
6NO+4NH3—→5N2+6H2O
6NO2+8NH3—→7N2+12H2O
NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g·cm-3。
计算:①该混合气体中NO与NO2的体积比。
②吸收后氨水的物质的量浓度(答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
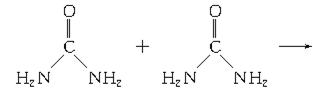
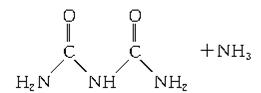
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80 mol NH3生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比。
查看答案和解析>>
科目:高中化学 来源: 题型:
对三种金属元素R、U、T进行了如下的实验:
| R | U | T | |
| 和稀硫酸反应 | 溶解并放出气体 | 无反应 | 未实验 |
| 和T的硝酸盐反应 | 表面上析出T | 表面上析出T | 未实验 |
据此可知这三种金属活动性由弱到强的顺序是( )
A.T、R、U B.T、U、R
C.U、R、T D.U、T、R
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com