
【题目】某绿色溶液A含有H+、Na+、Mg2+、Fe2+、Cu2+、SO![]() 、Clˉ、CO
、Clˉ、CO![]() 和HCO
和HCO![]() 离子中的若干种。取该溶液进行如下实验(已知Ag2SO4微溶于水,可溶于硝酸):
离子中的若干种。取该溶液进行如下实验(已知Ag2SO4微溶于水,可溶于硝酸):
①向溶液中滴加少量![]() 溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;
溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;
②取滤液B,先用HNO3酸化,再滴加0.001 mol·Lˉ1 AgNO3溶液,有白色沉淀生成。
下列说法不正确的是
A.溶液A中一定存在H+、SO![]() 和Clˉ
和Clˉ
B.溶液A中不存在Mg2+、CO![]() 和HCO
和HCO![]() ,不能确定Na+的存在
,不能确定Na+的存在
C.第②步生成的白色沉淀中只有AgCl,没有Ag2CO3
D.溶液A中存在Fe2+与Cu2+中的一种或两种,且可用NaOH溶液判断
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】如图所示是![]() 的两个性质实验,下列有关说法中正确的是
的两个性质实验,下列有关说法中正确的是![]()

A. 两个实验均表现了![]() 易溶于水
易溶于水
B. 两个实验均表现了![]() 易挥发
易挥发
C. 两个实验均表现了![]() 是碱性气体
是碱性气体
D. 两个实验均表现了![]() 是还原性气体
是还原性气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质。下列说法正确的是
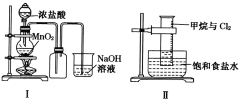
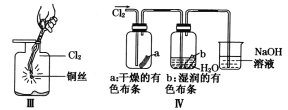
A. I图中:如果MnO2过量,浓盐酸就可全部被消耗
B. II图中:量筒中发生了加成反应
C. III图中:生成蓝色的烟
D. IV图中:湿润的有色布条能褪色将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯内盛有浓硝酸,在烧杯内放入用导线连接的铁、铅两个电极,已知原电池停止工作时,Fe、Pb均有剩余。下列说法正确的是( )
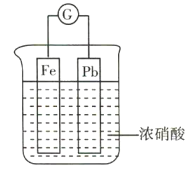
A.Fe比Pb活泼,故Fe始终作负极
B.Fe在浓硝酸中钝化,故始终不溶解
C.原电池停止工作时,溶液中有![]()
D.利用浓硝酸作电解质溶液不符合“绿色化学”的思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学想利用原电池反应检验金属的活动性强弱,两人均用镁片和铝片作电极,但甲同学将两电极放入6mol·L-1的H2SO4溶液中,乙同学将两电极放入6mol·L-1的NaOH溶液中,装置如图所示。

(1)写出图1中正极的电极反应式: _______________ 。
(2)图2中负极为 _______________ ,总反应的离子方程式为 ____________ 。
(3)甲、乙同学都认为“如果构成原电池的电极材料都是金属,则作负极的金屈应比作正极的金属活泼”,则甲同学得出的结论是 _______________ 的活动性更强,乙同学得出的结论是 _______________ 的活动性更强。
(4)由该实验得出的下列结论中,正确的有 _______________ (填序号)。
a.利用原电池反应判断金属活动性强弱时应注意原电池中的电解质溶液
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序表已过时,没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:
烧渣![]() 溶液
溶液![]() 绿矾
绿矾![]() 铁黄
铁黄
已知:FeS2和铁黄均难溶于水
下列说法不正确的是( )
A.步骤①,最好用硫酸来溶解烧渣
B.步骤②,涉及的离子反应为FeS2+14Fe3++8H2O=15Fe2++2SO![]() +16H+
+16H+
C.步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D.步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数(25 ℃) | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列有关说法正确的是( )
A.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)
B.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D.将a mol/L的HA溶液与a mol/L的NaA溶液等体积混合,混合液中:c(Na+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯![]() 是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用
是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用![]() 和NO制备ClNO并测定其纯度。请回答:
和NO制备ClNO并测定其纯度。请回答:
I.甲组的同学拟制备原料气NO和![]() ,制备装置如下图所示:
,制备装置如下图所示:
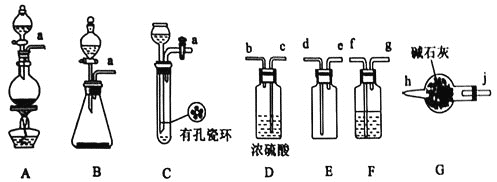
(1)若制备![]() 发生装置选B,则反应的离子方程式为_________________。若制备NO发生装置也选B,锥形瓶中放的是Cu片,则分液漏斗中的试剂为_______。
发生装置选B,则反应的离子方程式为_________________。若制备NO发生装置也选B,锥形瓶中放的是Cu片,则分液漏斗中的试剂为_______。
(2)欲收集一瓶干燥纯净的氯气,选择装置其连接顺序为:![]() ___
___![]() ___
___![]() ___
___![]() ___
___![]() ___
___![]() ___
___![]() 按气流方向,用小写字母表示
按气流方向,用小写字母表示![]() ,其中F装置的作用为________。
,其中F装置的作用为________。
II.乙组同学利用甲组制得的NO和![]() 制备NOCl,装置如图所示:
制备NOCl,装置如图所示:
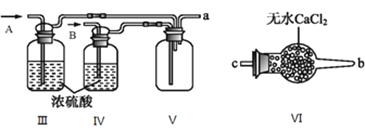
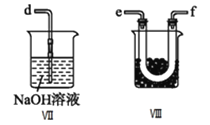
(3)为了使气体充分反应,从A处进入的气体是_______![]() 填
填![]() 或
或![]() 。
。
(4)装置Ⅲ、Ⅳ除可干燥NO、![]() 外,另一个作用是_________________。
外,另一个作用是_________________。
(5)装置Ⅷ的烧杯中盛放的试剂是______![]() 填编号:
填编号:![]() 水
水 ![]() 热水
热水 ![]() 冰水
冰水![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com