
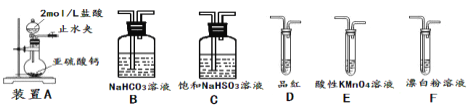
【题目】SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。
(1)二氧化硫的水溶液
①SO2易溶于水,常温常压下溶解度为1:40,其中有H2SO3生成。向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是__________。(结合有关平衡方程式简要说明)
②欲验证酸性:H2SO3>HClO,选用下面的装置,其连接顺序为:
A![]() ________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___。
________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___。
(2)二氧化硫的还原性
已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出)
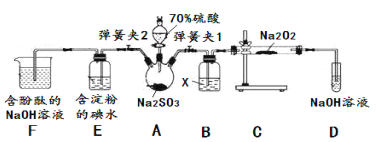
操作步骤 | 实验现象 | 解释原因 |
关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①____ |
若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2=2Na2SO3+O2 | |
关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中。 | E中②__________ | E中反应的离子方程式③________ |
F中④__________ | F中反应为2OH-+SO2=SO32-+H2O |
【答案】 SO2的水溶液中存在如下平衡SO2+H2O![]() H2SO3
H2SO3![]() H++HSO3-加入NaHSO3固体增加了c( HSO3- ) ,平衡左移,降低了SO2的溶解度 C
H++HSO3-加入NaHSO3固体增加了c( HSO3- ) ,平衡左移,降低了SO2的溶解度 C![]() B
B![]() E
E![]() D
D![]() F D中品红不褪色,F中产生白色沉淀 Na2O2 + SO2 =Na2SO4 E 中溶液蓝色褪去 SO2 + I2+2H2O=2I-+SO42-+4H+ F 中红色变浅或褪色
F D中品红不褪色,F中产生白色沉淀 Na2O2 + SO2 =Na2SO4 E 中溶液蓝色褪去 SO2 + I2+2H2O=2I-+SO42-+4H+ F 中红色变浅或褪色
【解析】(1)①在SO2的饱和水溶液中存在SO2+H2O![]() H2SO3
H2SO3![]() H++HSO3-的平衡,当加入NaHSO3固体增加了c( HSO3- ) ,平衡左移,降低了SO2的溶解度,故可以看到有气体SO2逸出;
H++HSO3-的平衡,当加入NaHSO3固体增加了c( HSO3- ) ,平衡左移,降低了SO2的溶解度,故可以看到有气体SO2逸出;
②次氯酸具有强氧化性、二氧化硫具有还原性,不能利用二氧化硫与次氯酸钙直接反应判断亚硫酸与次氯酸的酸性强弱,先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强碱性判断.A装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中,则:装置连接顺序为A![]() C
C![]() B
B![]() E
E![]() D
D![]() F ,其中装置C的作用是除去HCl气体,D中品红不褪色,F中出现白色沉淀,可证明亚硫酸的酸性强于次氯酸;
F ,其中装置C的作用是除去HCl气体,D中品红不褪色,F中出现白色沉淀,可证明亚硫酸的酸性强于次氯酸;
(2)A中制备二氧化硫,X干燥二氧化硫,C中检验SO2与Na2O2反应是否有氧气,D中氢氧化钠溶液吸收剩余的二氧化硫,防止污染空气.E装置检验I-还原性弱于SO2,F装置验证二氧化硫为酸性气体,并吸收二氧化硫,防止污染空气.
①SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为Na2O2 + SO2 =Na2SO4;
②E 中溶液蓝色褪去,③说明SO2有还原性,被I2氧化,发生反应的离子方程式为SO2 + I2+2H2O=2I-+SO42-+4H+;
④因SO2是酸性氧化物,能发生2OH-+SO2=SO32-+H2O,则F 中含酚酞的NaOH显红色,通入SO2后红色变浅或褪色。


科目:高中化学 来源: 题型:
【题目】化学是以实验为基础的自然科学,下列实验操作方法正确的是()
A. 酒精灯在桌子上歪倒着火,立即用水浇灭
B. 给试管中的液体加热时,可加入碎瓷片或不时移动试管,以免暴沸伤人
C. 使用pH试纸测量溶液的酸碱性时,先把pH试纸用蒸馏水润湿后,再测量
D. 将润湿的红色石蕊试纸置于集气瓶内部,试纸变蓝说明氨气已收集满
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是 ( )
A. 配制FeCl2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸
B.向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则Ksp( BaCO3)<Ksp( BaSO4)
C.过量的铁在氯气中燃烧可生成氯化亚铁
D.已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-![]() I2+I-
I2+I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物分子式为C4H8,据此推测其结构和性质不可能的是 ( )
A.它与乙烯可能是同系物
B.一氯代物可能只有一种
C.分子结构中甲基的数目可能是0、1、2
D.等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液中,c(Cl-) 最大的是( )
A.500 mL 1 mol/L KCl B.800 mL 0.5 mol/L MgCl2
C.250 mL 1 mol/L FeCl3 D.200 mL 1 mol/L CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)下列物质中属于同位素的是__________;属于同素异形体的是__________。
A.O2、O3 B. ![]() Cl和
Cl和![]() Cl
Cl
C.Fe2+、Fe3+ D.H2O、D2O、T2O
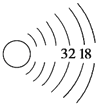
(2)据报道,某些花岗岩会产生放射性的稀有气体氡,从而对人体产生伤害,请将以下Rn的原子结构示意图补全。_______
(3)下列四种物质中①Ar,②CO2,③K2S,④NaOH,只有存在共价键的物质是___;(填编号)用电子式表示③的形成过程:__________。
(4)硅酸盐的组成比较复杂,常用氧化物的形式表示。石棉Mg3Ca(SiO3)4表示为氧化物形式为:__________。
(5)若K37ClO3+6H35C1===KCl+3Cl2↑+3H2O,则此反应中生成氯气的相对分子质量约为_________(计算结果保留三位有效数字)。
(6)将NaHSO4溶于水,破坏了NaHSO4中的______(填化学键类型),NaHSO4在熔融状态下电离,破坏了______(填化学键类型),写出其在熔融状态下的电离方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用。
Ⅰ、脱硝:
已知:①H2的热值为142.9kJ/g(热值是表示单位质量的燃料完全燃烧生成稳定的化合物时所放出的热量);
②N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:_______
Ⅱ、脱碳
(1)CO与空气可设计成燃料电池(以熔融的碳酸盐为电解质)。写出该电池的负极反应式:_______。
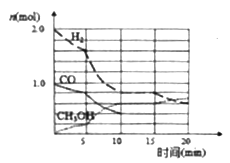
(2)甲醇是一种可再生能源,工业上可用合成气制备甲醇,反应为CO(g)+2H2(g) ![]() CH3OH(g)。某温度下在容积为VL的密闭容器中进行反应,其相关数据戔右图;反应开始至平衡时,用H2表示化学反应速率为________。该温度下CO的平衡转化率为_________。
CH3OH(g)。某温度下在容积为VL的密闭容器中进行反应,其相关数据戔右图;反应开始至平衡时,用H2表示化学反应速率为________。该温度下CO的平衡转化率为_________。
(3)向1L密闭容器中加入1molCO2、3molH2,在适当的条件下,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g).
CH3OH(g)+H2O(g).
①下列叙述能说明此反应达到平衡状态的是___________。
a.混合气体的平均相对分子质量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时又3molH-H键断裂
②相同条件下,在容积都为1L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后反应达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2、3molH2 | amol CO2、3amolH2 bmolCH3OH(g)、bmolH2O(g) |
若甲中平衡后气体的压强为开始的0.6倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆向反应方向进行,则b的取值可能为_________(填序号)
a.0.7 b.0.9 c.1.2
若保持温度不变,起始加入0.5molCO2、0.5molH2、0.5molCH3OH(g)、0.5molH2O(g) 则此反应速率的关系:v正__________v逆。(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com