
| A.283. kJ·mol-1 | B.+172.5 kJ·mol-1 |
| C.-172.5 kJ·mol-1 | D.-504 kJ·mol-1 |
科目:高中化学 来源:不详 题型:单选题
| A.①②⑤ | B.①②④⑤ | C.①②③④⑤ | D.①③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
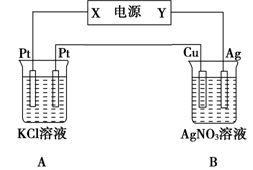
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+4H2(g)
CO2(g)+4H2(g)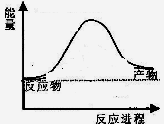
| 化学键 | C—H | O—H | C=O | H—H |
| 吸收热量(kJ/mol) | a | b | c | d |
 CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
|
已知:① Cu(s)+H2O2(l)+2H+ (aq)=Cu2+(aq)+2H2O(l) △H 1 ②2H2O(l)=2H2(g)+O2(g) △H 2 ③2H2O2(l)=2H2O(l)+O2 (g) △H 3 ④Cu(s)+2H+ (aq)=Cu2+(aq)+H2 (g) △H4 则ΔH4的正确表达式为( )
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g)ΔH=-92.2kJ·mol-1
2NH3(g)ΔH=-92.2kJ·mol-1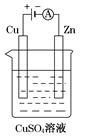
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com