
| A. | 使甲基橙呈红色的溶液:Na+、NH4+、AlO2-、CO32- | |
| B. | 8% H2O2溶液:H+、Fe2+、SO42-、Cl- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | 澄清透明的溶液中:Cu2+、Na+、NO3-、SO42- |
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 6 种 | C. | 3 种 | D. | 5 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20ml 0.1mol/L 酒石酸(用H2T表示)溶液中逐渐滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )
常温下,向20ml 0.1mol/L 酒石酸(用H2T表示)溶液中逐渐滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )| A. | HT-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=20mL时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=30mL时,溶液中存在c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=40ml时,溶液中存在c(OH-)=c(HT-)+2 c(H2T)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
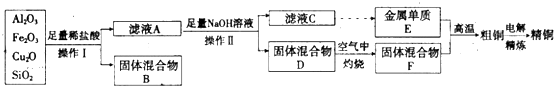
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纪录片《穹顶之下》中的雾霾属于小颗粒纳米级聚合物,我们可利用丁达尔现象鉴别 | |||||||
| B. | 安装煤炭“固硫”、“脱硝”装置,可以有效避免“穹顶”出现的概率 | |||||||
| C. | 我国是煤多油少的国家,煤层气俗称瓦斯气,是一种新利用的能源,煤层气相比直接烧煤更清洁,利于对抗雾霾 | |||||||
| D. | 下表为全国主要机场机场2014年PM2.5均值,PM2.5口罩材质为碳纤维毡垫、高分子织物、无纺布等,是一种间隙比半透膜还小的分子筛.
|
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物 质 | 试 剂 | |
| A | Na2SO4溶液(NaBr) | Cl2 |
| B | KNO3(NaCl) | AgNO3溶液 |
| C | Cl2(HCl) | 饱和食盐水 |
| D | CO2(HCl) | 饱和Na2CO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com