
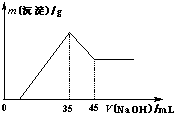
 准确称取6.0g铝土矿样品(含Fe2O3),加入100mL稀硫酸中,充分反应后向滤液中加入10mol?L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如上图所示.则所用硫酸物质的量浓度为
准确称取6.0g铝土矿样品(含Fe2O3),加入100mL稀硫酸中,充分反应后向滤液中加入10mol?L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如上图所示.则所用硫酸物质的量浓度为 n(NaOH)=
n(NaOH)= ×0.35mol=0.175mol,
×0.35mol=0.175mol,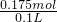 =1.75mol/L,
=1.75mol/L,

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙、丙、丁均具有如图所示的结构或结构单元.实线表示共价键,X、Y可同可不同.
甲、乙、丙、丁均具有如图所示的结构或结构单元.实线表示共价键,X、Y可同可不同.查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
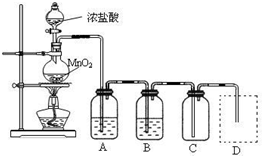
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 | ______ | 固体物质中有FeCl3 |
| 向a溶液中滴加 酸性KMnO4溶液 | KMnO4溶液紫色 不褪色 | 固体物质中不含______ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
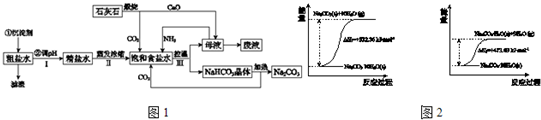
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
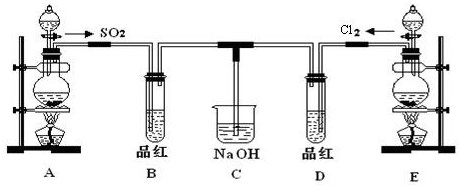
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com