
已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
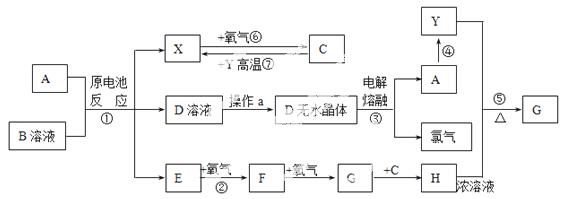
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
____________________________________________________________________;
(2)从D溶液制备D的无水晶体的“操作a”为__________________________;
(3)E的电子式为_________________________________;
(4)反应⑤的化学方程式为_____________________________________________;
(5)原电池反应①中正极的电极反应式为_________________________________。
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
一定条件下,可逆反应C(s)+CO2(g)  2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④ B.①③ C.②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.1mol铜与足量的硫反应时失去的电子数为NA
B.7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA
C.0.5 mol NO2气体降温后颜色变浅,其所含的分子数仍然为0.5 NA
D.1molFeCl3和沸水完全反应转化为氢氧化铁胶体后,其中胶体粒子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
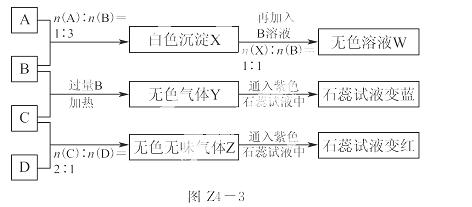
现有四瓶丢失标签的 NaOH 、Na 2CO3 、AlCl3 、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如图Z4-3所示(无关物质已经略去):
2CO3 、AlCl3 、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如图Z4-3所示(无关物质已经略去):
请回答:
(1)Y、Z 的化学式分别为:Y__________;Z__________;X 与 B 反应的离子方程式为_________________________。
(2)D溶液pH________(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)_____________ _______。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是__________(用化学式表示)。
(4)请写出C与过量B反应(加热)的离子方程式:____________________。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有短周期元素构成的3种单质甲、乙、丙,它们在一定条件下能发生如下变化,部分产物已略去。
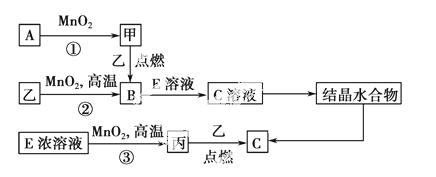
(1)若反应①可在常温下进行,则A的电子式为________。若反应①需在加热条件下进行,则反应①的化学方程式为____________________________。
(2)反应②的化学方程式为________,该反应是________(填“放热”或“吸热”)反应。
(3)从C溶液中得到C需经过两步操作:先从C溶液中得到晶体,再将得到的晶体转化为C。从C溶液中得到晶体的过程被称为________,将得到的晶体转化为C的实验条件是____________________________________。
(4)反应③中氧化剂与还原剂的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Mg及其化合物可以发生如下转化(部分反应物、生成物或水已略去),已知X、Y、Z为气态单质,B常温下为液态,D的焰色为黄色,C和G混合冒白烟并生成A。
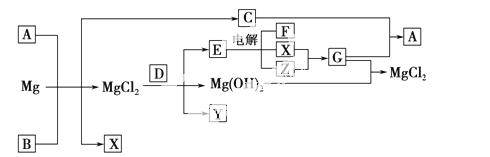
(1)写出下列物质的化学式:A________;Y________。
(2)请用电子式表示B的形成过程:_________________________________
_________________________________ ______。
______。
(3)请用电离或水解平衡解释A+B +Mg—→C+X+MgCl2的原因________
+Mg—→C+X+MgCl2的原因________
________________________________________________________________。
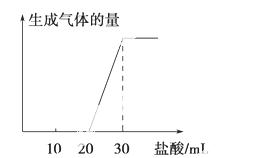
(4)将1 mol CO2通入1 L溶质为F的溶液中,充分反应后,再向混合液中逐滴滴加盐酸,所加盐酸的体积与生成的气体的关系如图所示, 原F溶液的物质的量浓度为________ mol·L-1。
原F溶液的物质的量浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中都是既有离子键又有共价键的一组是( )
A.NaOH、H2O、NH4Cl
B.KOH、Na2O2、(NH4)2S
C.MgO、CaBr2、NaCl
D.Na2SO4、HCl、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。
X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是( )
A.原子半径的大小顺序: r(Y)>r(Z)>r(W)
B.元素Z、W 的简单离子的电子层结构不同
C.元素Y 的简单气态氢化物的热稳定性比Z 的强
D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W有如图所示的转化关系,则X、Y、Z可能是( )
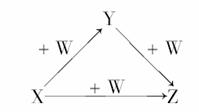
①N2、NO、NO2 ②AlCl3、Al(OH)3、NaAlO2 ③S、SO2、SO3 ④NaOH、Na2CO3、NaHCO3
A.①②③④ B.①②
C.②④ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com