
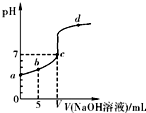
 在25℃下,向10.00mL0.01mol?L-1某一元酸HA溶液中逐滴加入0,.01mol.L-1NaOH溶液,溶液pH变化曲线如图所示.下列说法正确的是( )
在25℃下,向10.00mL0.01mol?L-1某一元酸HA溶液中逐滴加入0,.01mol.L-1NaOH溶液,溶液pH变化曲线如图所示.下列说法正确的是( )| A、HA是强酸 |
| B、b点表示的溶液中:c(HA)=c(A-) |
| C、c点时:V=10.00mL |
| D、b、c、d三点表示的溶液中一定都存在:c(Na+)+c(H+)=c(A-)+c(OH-) |


科目:高中化学 来源: 题型:
| A、甲、乙的结构必然相同 |
| B、甲、乙的组成元素必然相同 |
| C、甲、乙的化学性质相似 |
| D、甲乙的相对分子质量必然相差14n(n为正整数) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 氢氧化钡 | 蔗糖溶液 | 硫酸钡 | 醋酸 | 氢气 |
| B | 胆矾 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| C | 盐酸 | 石灰水 | 苛性钾 | 水 | 氨气 |
| D | 石灰石 | 水玻璃 | 氯化钙 | 氢氧化铁 | 碳酸钙 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
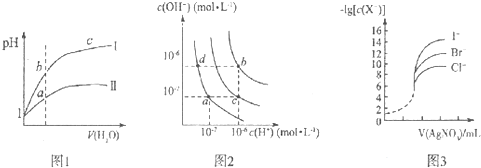
| A、图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B、图2中纯水仅升高温度,就可以从a点变到c点 |
| C、图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 |
| D、用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol?L-1 Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该电池中用固态金属Na为负极,S单质作为正极,但S单质须负载在导电材料上 |
| B、该电池的电解质必须具备室温下传导Na+的能力,但不宜用NaOH溶液作为电解液 |
| C、n值越大则该电池的能量密度越高 |
| D、该电池充电过程中阳极的电极反应式:Na2Sn-2e-=2Na++nS,故充电时Na+从阳极向阴极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
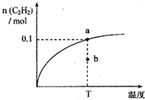 温度为T时,向2.00L恒容密闭容器中充入1.00molCH4,发生反应:2CH4(g)
温度为T时,向2.00L恒容密闭容器中充入1.00molCH4,发生反应:2CH4(g)
| ||
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(CH4)/mol | 1.00 | 0.84 | 0.81 | 0.80 | 0.80 |
| A、温度T时,前5s H2平均速率为0.024mol?L-1?s-1 |
| B、温度T时,b点 υ(逆)>υ(正) |
| C、该反应的平衡常数随温度升高逐渐减小 |
| D、温度T时,若向2.00L恒容密闭充入2.00molC2H2和6.00molH2,达到平衡时,C2H2转化率大于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
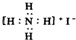
14 6 |
| A、3个 | B、4个 | C、5个 | D、6个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com