
钡在氧气中燃烧时得到一种钡的氧化物晶体,晶体结构如图所示,有关说法正确的是( )
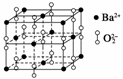
A.该晶体属于分子晶体 B.晶体的化学式为Ba2O2

科目:高中化学 来源: 题型:
请填写下列物质的结晶方法。
(1)氯化钠:________________。
(2)硝酸钾:________________。
(3)硫酸铜晶体:______________。
(4)从FeCl3溶液中得到FeCl3·6H2O固体__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组分子之间存在氢键的是( )
①C2H6和CCl4 ②NH3和C6H6 ③CH3COOH和H2O ④CHCl3和CH2Cl2 ⑤HCHO和C2H5OH
A.①②④ B.③⑤
C.①②③④⑤ D.都不存在
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.冰融化时,分子中H—O键发生断裂
B.原子晶体中,共价键越强,熔点越高
C.分子晶体中,共价键键能越大,该分子晶体的熔、沸点一定越高
D.分子晶体中,分子间作用力越大,该物质越稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
当下列物质以晶体形式存在时,其所属晶体类型和所含化学键类型分别相同的是( )
A.氯化钠和氯化氢 B.二氧化碳和二氧化硅
C.四氯化碳和四氯化硅 D.单质铁和单质碘
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期表中的位置如下图所示:
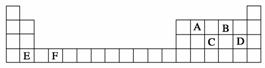
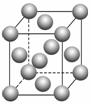
(1)写出F的基态原子核外电子排布式: 。E的晶胞结构如上图所示,该晶胞中含有金属原子的数目为________。
(2)C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是____________________________。
(3)由A、B、D三种元素形成的一种物质俗称光气,分子中A原子采取sp2杂化成键。光气分子的结构式是________,其中碳氧原子之间的共价键是________(填序号):
a.2个σ键
b.2个π键
c.1个σ键、1个π键
(4)
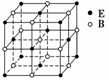
EB晶胞
EB晶胞如右图所示,EB晶体中E2+的配位数为____________,EB晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:EB-3 401 kJ·mol-1、NaCl-786 kJ·mol-1。导致两者晶格能差异的主要原因是____________________________________________。
(5)元素A形成的单质的晶体类型可以是原子晶体,如________(填写物质名称),也可以是________,如C60。
查看答案和解析>>
科目:高中化学 来源: 题型:
在BaCl2溶液中通入SO2气体,未见沉淀生成,若再通入下列四种气体①Cl2 ②NH3 ③NO2 ④H2S均会产生沉淀。
回答下列问题:
(1)通入四种气体时产生的沉淀分别是
①______________;②_____________;③_____________;④_____________。
(2)用方程式表示①和④产生沉淀的原因
①________________________________________________________________________;
②________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
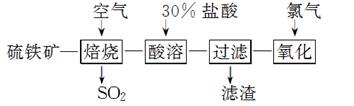
FeCl3·6H2O(晶体粗品)
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)??2SO3(g),该反应的平衡常数表达式为K=____;过量的SO2与NaOH溶液反应的化学方程式为________________________________________________________________________。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是________________________、________________________________________________________________________。
(3)通氯气氧化时,发生的主要反应的离子方程式为________________________________;
该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为_______________________。
(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列说法正确的是( )
A.34S原子核内中子数为16
B.16O2比18O2沸点更低
C.2H+的酸性比1H+的酸性更强
D.13C和15N原子核内的质子数相差2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com