
(本题共12分)
Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g) = N2O4(l) ΔH1=-19.5kJ∙mol-1
②N2H4(l) + O2 (g)=N2(g)+2H2O(g) ΔH2 =-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
Ⅱ、一定质量的液态化合物 在标准状况下的一定质量的
在标准状况下的一定质量的 中恰好完全燃烧,反应方程式为:
中恰好完全燃烧,反应方程式为: 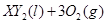 ===
===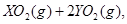 冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56
冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56  则:
则:
(1)反应前 的体积是
。
(2)化合物
的体积是
。
(2)化合物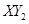 的摩尔质量是
。
的摩尔质量是
。
(3)若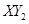 分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为
和
(写元素符号)。
分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为
和
(写元素符号)。
I、(1)5 (2)2NH3+NaClO==N2H4+NaCl+H2O
(3)2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H=-1048.9kJ·mol-1
(4)2N2H4 -4e-+4 OH-==2N2+4H2O
Ⅱ、 (1)672 mL (2)76 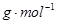 (3)C
、 S
(3)C
、 S
【解析】I、 (1)N原子的原子结构示意图为: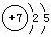 ,故其L层上有5个电子;
,故其L层上有5个电子;
(2)NH3+NaClO——N2H4,根据元素守恒还应生成NaCl和H2O,观察法可配平方程式为 2NH3+NaClO==N2H4+NaCl+H2O;
(3)肼与N2O4反应生成N2和水蒸气:2N2H4 +N2O4==3N2+4H2O,观察已知的两个热方程式可知,②×2-①得:2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H=△H2×2-△H1== -1048.9kJ·mol-1
(4)“肼—空气燃料电池是一种碱性电池”中O2在正极反应,故负极是肼发生反应:2N2H4 -4e-+4 OH-==2N2+4H2O。
Ⅱ、(1)由反应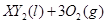 ===
===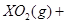
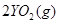 可知,反应前后气体的体积没有发生变化,故V
可知,反应前后气体的体积没有发生变化,故V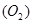 =672
mL。
=672
mL。
(2)由m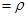 V,生成物的质量m=0.672
V,生成物的质量m=0.672 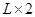 .56
.56 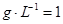 .72 g,
.72 g,
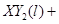
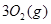 ===
===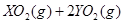
0.01 mol 0.03 mol
所以M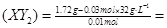 76
76
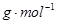
(3)由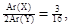 Ar(X)+ 2Ar(Y)=76,得Ar(X)=12,
Ar(Y)=32,则X为C,Y为S。
Ar(X)+ 2Ar(Y)=76,得Ar(X)=12,
Ar(Y)=32,则X为C,Y为S。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源:2011-2012学年上海市松江区高三上学期期末(1月)考试化学试卷(解析版) 题型:填空题
(本题共12分)
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:

根据题意回答:
1.实验中需用0.8mol/L的硫酸800 mL,若用98%的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
A.10 mL B.20 mL C.50 mL D.100 mL
2.加入的NaClO可与Mn2+反应:Mn2+ + ClO- + H2O → MnO2↓ + 2H+ + Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
3.滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 。
4.在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法 。
5.已知MgSO4、CaSO4的溶解度如下表:
|
温度(℃) |
40 |
50 |
60 |
70 |
|
MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
|
CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 。“操作I”是将滤液继续蒸发浓缩,冷却结晶, ,便得到了MgSO4·7H2O。
6.实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,则MgSO4·7H2O的产率为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市松江区高三上学期期末(1月)考试化学试卷(解析版) 题型:实验题
(本题共12分)
下图是模拟工业制硝酸原理的实验装置。先用酒精灯对硬质玻璃管里的三氧化二铬加热,然后把空气鼓入盛有浓氨水的锥形瓶,当三氧化二铬保持红热状态时,移去酒精灯。根据题意回答:
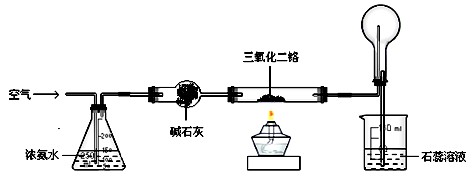
1.硬质玻璃管里发生反应的化学方程式为 。
当三氧化二铬红热时,要移去酒精灯,原因是: 。
2.圆底烧瓶里的实验现象是 ,鼓入空气的作用是 。
3.实验过程中,如果慢慢地鼓入空气,石蕊溶液的颜色 。
4.实验结束后,在圆底烧瓶内壁上有时会看到少量无色晶体,写出生成该晶体的化学方程式: 。
5.新制的三氧化二铬催化效果较好。实验室一般用加热分解(NH4)2Cr2O7的方法制三氧化二铬,反应的化学方程式为 。
6.工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁或浓硫酸,然后 (填一种操作名称)。实验室里保存浓硝酸的方法是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市普陀区高三4月质量调研(二模)化学试卷(解析版) 题型:填空题
(本题共12分)六水合高氯酸铜 [Cu(C1O4)2 ·6H2O]是一种蓝色晶体,易溶于水,120℃时开始分解。实验室用硫酸铜的粗产品制备少量高氯酸铜晶体的流程如下:

已知:
|
离子 |
溶液pH值 |
|
|
开始沉淀 |
沉淀完全 |
|
|
Fe2+ |
7.6 |
9.6 |
|
Fe3+ |
2.7 |
3.7 |
|
Cu2+ |
5.2 |
6.4 |
(1).写出A→B过程中发生反应的离子方程式为 。
(2).溶液C中加入稀硫酸调至pH=1的目的是________________________________________。
(3).如欲检验溶液C中的杂质是否除净,其操作是 。
(4).蒸发至__________(填写现象),然后经过冷却结晶、过滤、洗涤、 (填写操作),得到纯净的蓝色晶体。
(5).为了测定硫酸铜的粗产品的纯度,某同学称量硫酸铜的粗产品2.000g、 、 、(填写实验步骤)过滤、洗涤沉淀、在空气中灼烧,至质量不再改变时,称得质量为0.58816 g。
(6).该样品的纯度为___________。如果样品的实际纯度为93.2%,则测定的相对误差为__________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市普陀区高三4月质量调研(二模)化学试卷(解析版) 题型:实验题
(本题共12分)海水中有丰富的卤素资源,含量最高的食盐(NaCl)不但是人类生活不可缺少的物质,而且是重要的化工原料。
(1).实验室里常用NaCl制取HCl。请在下图中选择合适的仪器用于发生HCl气体:
(填写仪器编号)。
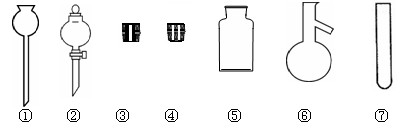
(2).在实验室里使用与制取HCl相同的实验装置和条件,将浓硫酸滴入NaBr(s),可以观察到的现象是 。
(3).产生上述现象的原因是 。
(4).收集HCl(g)和HBr(g)的实验时不可缺少的实验操作是: 。
(5).除水之外,限用 HCl(g)、HBr(g)和HI(g),还需要 (填写试剂的化学式),就能设计实验比较氯、溴、碘的化学活泼性。
(6).工业上可用食盐作为一种主要原料,经不同的方法生产纯碱。联合制碱法(侯氏制碱法)与氨碱法(索氏制碱法)相比,其优点是: 、 和避免产生大量含CaCl2的废液。
查看答案和解析>>
科目:高中化学 来源:2014届四川省高一5月月考化学试卷(解析版) 题型:填空题
(本题共12分)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
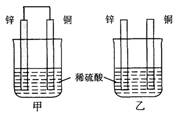
(1)下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的c(H+)均增小
(2)在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________。
(5) 甲中锌片上发生的电极反应: _________________________;
(6) 若甲中两电极的总质量为60 g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47 g,则:氢气的体积(标准状况)为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com