
| ||
| 高温高压 |
| 1 |
| 4 |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
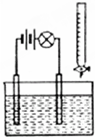 在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A、向盐酸中逐滴加入食盐溶液 |
| B、向硫酸溶液中逐滴加入氢氧化钠溶液 |
| C、向硫酸溶液中逐滴加入氢氧化钡溶液 |
| D、向醋酸溶液中逐滴加入氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca(HCO3)2溶液中滴加少量NaOH溶液 Ca2++HCO3-+OH-═CaCO3↓+H2O |
| B、NaHSO4溶液中滴加少量Ba(OH)2溶液 H++SO42-+Ba2++OH-═BaS04↓+H2O |
| C、FeBr2溶液中通人过量C12 2Fe2++6Br -+4C12═Fe3++3Br2+8C1- |
| D、FeSO4溶液中加入H2O2溶液的反应:Fe2++2H2O2+4H+═Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、2:3 |
| C、3:1 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定是加入金属镁的一端下倾 |
| B、一定是加入金属铝的一端下倾 |
| C、一定是仍然保持平衡 |
| D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙和盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
| C、向稀盐酸溶液中加铁:2Fe+6H+═2Fe3++3H2↑ |
| D、向硝酸银溶液中加盐酸:Ag++C1-═AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6g铁粉与硝酸反应失去的电子数一定为0.3NA | |||||
B、1.8g重水(D2O,D为
| |||||
| C、常温、常压下,22.4LNO2和N2O4混合气体中含有原子总数为3NA | |||||
| D、1mol/L的氨水与等质量的水混合后(忽略体积变化),所得溶液浓度大于0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com