
| Ũ���� |
| 170�� |
| Ũ���� |
| 170�� |
| H2O |
| H2O |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��֪����������K2SO4?MgSO4?2CaSO4��ˮ�д�������ƽ�⣺
��֪����������K2SO4?MgSO4?2CaSO4��ˮ�д�������ƽ�⣺| A�������ϵ�м��뱥��NaOH��Һ���ܽ�ƽ�������ƶ� |
| B�������ϵ�м��뱥��̼������Һ���ܽ�ƽ�������ƶ� |
| C�������¶ȣ���Ӧ��������ƽ��������Ӧ�����ƶ� |
| D����ƽ���Ksp=c��Ca2+��?c��K+��?c��Mg2+��?c��SO42-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��10mLһ�����ʵ���Ũ�ȵ������еμ�һ�����ʵ���Ũ�ȵ�NaOH��Һ����pH�仯��ͼ��ʾ��������Һ�����ʵ���Ũ�ȷֱ��ǣ�������
��10mLһ�����ʵ���Ũ�ȵ������еμ�һ�����ʵ���Ũ�ȵ�NaOH��Һ����pH�仯��ͼ��ʾ��������Һ�����ʵ���Ũ�ȷֱ��ǣ�������| A | B | C | D | |
| ��������ʵ���Ũ�� mol/L |
0.12 | 0.04 | 0.03 | 0.09 |
| NaOH�����ʵ���Ũ�� mol/L |
0.04 | 0.12 | 0.09 | 0.03 |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | ʵ����� | ʵ������ | ���� |
| A | �����ݵ�������Һ�зֱ�μӱ���NaCl��Һ��CuSO4��Һ | ���й������� | �����ʾ��������� |
| B | ����ҺX���ȵμ�ϡ���ᣬ�ٵμ�Ba��NO3��2��Һ | ���ְ�ɫ���� | ��ҺX��һ������SO42- |
| C | Al������ϡ������ | ��ʼ������ | Al�����汻���������ۻ����γ����ܵ�����Ĥ |
| D | ��Ũ�Ⱦ�Ϊ0.1mol?L-1NaCl��NaI�����Һ�еμ�����AgNO3��Һ | ���ֻ�ɫ���� | Ksp��AgCl����Ksp��AgI�� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | ���� | ��ѡ�Լ� | ���ӷ���ʽ |
| NaCl��Һ | Na2CO3 | ||
| Mg�� | Al �� | ||
| FeCl2��Һ | FeCl3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
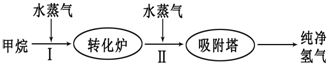

| �¶�/�� | 400 | 500 | 830 |
| ƽ�ⳣ��K | 10 | 9 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ɫ��Һ�У�K+��Na+��Cu2+��SO42- | ||
B��
| ||
| C����ˮ�������C��OH-��=1��10-12mol?L-1����Һ��NH4+��HCO3-��Na+��Cl- | ||
| D��c��OH-��=10-13mol?L-1����Һ�У�Al3+��NO3-��I-��Cl- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com