
| A. | ①②③④⑧ | B. | ①②③④⑤ | C. | ②③④⑤⑧ | D. | ④⑤⑥⑦⑧ |
分析 Na2O2具有强氧化性,与水反应后溶液呈碱性,具有还原性的离子和能与OH-反应的离子浓度减小,据此解答.
解答 解:①S2- 具有还原性,能够被过氧化钠氧化,硫离子浓度减小,故选;
②SO32- 具有还原性,能够被过氧化钠氧化,亚硫酸根离子浓度减小,故选;
③HCO3- 能够与氢氧化钠反应生成碳酸钠,所以碳酸氢根离子浓度减小,故选;
④Fe2+ 具有还原性,能够被过氧化钠氧化,二价铁离子浓度减小,故选;
⑤CO32- 与过氧化钠、氢氧化钠都不反应,离子浓度不变,故不选;
⑥SO42-与过氧化钠、氢氧化钠都不反应,离子浓度不变,故不选;
⑦CH3COO- 与过氧化钠、氢氧化钠都不反应,离子浓度不变,故不选;
⑧NH4+能够与氢氧化钠反应,氨根离子浓度减小,故选;
故选:A.
点评 本题考查了元素化合物知识,明确过氧化钠的性质是解题关键,注意过氧化钠的氧化性和与水反应的产物,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 钠浮在煤油层上,不反应 | |
| B. | 钠沉在煤油层下,不反应 | |
| C. | 钠沉在煤油层下浮在水层上,在交界处剧烈反应 | |
| D. | 钠沉在水层下剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶前检查它是否漏水 | |
| B. | 容量瓶用水洗净后,在干燥箱中 干燥 | |
| C. | 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线 | |
| D. | 定容后,盖好瓶塞,用食指顶住瓶塞,手握住瓶进颈,左右振荡摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,用浓度为0.1000mol•L-1 的NaOH溶液滴定20mL 浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 的NaOH溶液滴定20mL 浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX | |
| B. | 根据滴定曲线,可得Ka(HY)≈10-6 | |
| C. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) | |
| D. | HY与HZ混合,达到平衡时:c(H+)═c(Y-)+c(Z-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1 L 0.1 mol•L-1 NH4NO3溶液中NH4+、NO3-的数目均为0.1NA | |
| B. | 标准状况下,22.4 L N2和O2的混合气体中含有的原子总数为2NA | |
| C. | 常温常压下,16 g CH4中含有共价键的数目为NA | |
| D. | 16 g CH4与18 g NH4+所含质子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
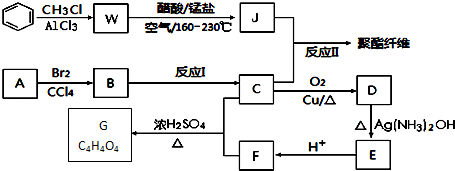
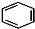 +RCl$\stackrel{AlCl_{3}}{→}$
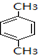
+RCl$\stackrel{AlCl_{3}}{→}$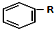 +HCl(-R为烃基)
+HCl(-R为烃基)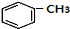 $→_{空气/160-230℃}^{醋酸/锰盐}$
$→_{空气/160-230℃}^{醋酸/锰盐}$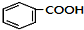
 .
. .
.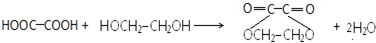 .
.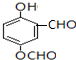 (写出一种即可);
(写出一种即可);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氧化物 | 酸 | 碱 | 盐 | |
| A | CuO | HCl | NH3•H2O | Na2SO4 |
| B | CO2 | CH3COOH | 火碱 | Cu(OH)2 |
| C | H2O | HBr | 纯碱 | BaSO3 |
| D | MnO2 | HClO | 生石灰 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com