
 以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法.
以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法.分析 (1)已知:①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-35.4kJ•mol-1
②CO(g)+2H2(g)?CH3OH(g)△H2=-90kJ•mol-1
根据盖斯定律,①×2+②×2可得:2CH4(g)+O2(g)?2CH3OH(g),则△H3=2△H1+2△H2;
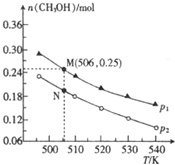
(2)①由图可知,压强一定时,温度越高,CH3OH的物质的量越小,说明升高温度平衡向逆反应方向移动;
②正反应为气体体积减小的反应,温度一定时,增大压强,平衡向正反应方向移动,甲醇的物质的量增大,故压强P1>P2,压强越大,反应速率越快;
③在可逆反应中,增加一种反应物浓度可以提高另一反应物的转化率;
④图中M、N点温度相同,平衡常数相同,M点时,容器体积为10L,平衡时CH3OH的物质的量为0.25mol,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始(mol/L):0.1 0.275 0 0
变化(mol/L):0.025 0.075 0.025 0.025
平衡(mol/L):0.075 0.2 0.025 0.025
根据K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$计算;
(3)设转化的二氧化碳的物质的量为x,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始(mol):a b 0 0
转化(mol):x 3x x x
平衡(mol):a-x b-3x x x
则CO2的体积分数为$\frac{a-x}{a+b-2x}$,据此判断.
解答 解:(1)已知:①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-35.4kJ•mol-1,
②CO(g)+2H2(g)?CH3OH (g)△H2=-90.1kJ•mol-1,
根据盖斯定律,(①+②)×2可得:2CH4(g)+O2(g)?2CH3OH(g),故△H3=2△H1+2△H2=2×(-35.4kJ•mol-1-90.1kJ•mol-1)=-251kJ•mol-1,
故答案为:-251;
(2)①由图可知,压强一定时,温度越高,CH3OH的物质的量越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,故△H<0,
故答案为:<;
②正反应为气体体积减小的反应,温度一定时,增大压强,平衡向正反应方向移动,甲醇的物质的量增大,故压强P1>P2,压强增大,反应速率也增大,所以v(N)<v(M),
故答案为:<;
③在可逆反应中,增加一种反应物浓度可以提高另一反应物的转化率,所以为提高CO2的转化率除可改变温度和压强外,还可采取的措施是增大$\frac{n({H}_{2})}{n(C{O}_{2})}$的值,
故答案为:增大$\frac{n({H}_{2})}{n(C{O}_{2})}$的值;
④图中M、N点温度相同,平衡常数相同,M点时,容器体积为10L,平衡时CH3OH的物质的量为0.25mol,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始(mol/L):0.1 0.275 0 0
变化(mol/L):0.025 0.075 0.025 0.025
平衡(mol/L):0.075 0.2 0.025 0.025
故平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.025×0.025}{0.075×0.{2}^{3}}$=1.04,
故答案为:1.04;
(3)设转化的二氧化碳的物质的量为x,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始(mol):a b 0 0
转化(mol):x 3x x x
平衡(mol):a-x b-3x x x
则CO2的体积分数为$\frac{a-x}{a+b-2x}$,要使$\frac{a-x}{a+b-2x}$为恒定的值,则a=b,
故答案为:a=b.
点评 本题考查化学平衡计算与影响因素、化学平衡常数、反应热计算等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氢气是一种新型的绿色能源,又是一种重要的化工原料.
氢气是一种新型的绿色能源,又是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Cl-、OH- | B. | H+、Ca2+、CO32-、NO3- | ||
| C. | Cu2+、K+、SO42-、NO3- | D. | Na+、HCO3-、K+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②⑤ | C. | ①②④ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com