
| A.某反应的焓变小于零,该反应一定能自发进行 |
| B.用湿润的pH试纸测稀盐酸溶液的pH为3.52 |
| C.草木灰(K2CO3)是钾肥,硫酸铵是氮肥,二者混合施用可以提高肥效 |
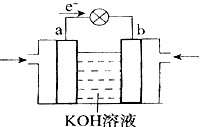
| D.原电池是将化学能转变为电能的装置 |
科目:高中化学 来源:不详 题型:问答题
 CH3OH(g)
CH3OH(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
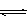 CH3OH(g)的化学平衡常数为__________.
CH3OH(g)的化学平衡常数为__________.
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2(g);ΔH= 。(用含ΔH1、ΔH2的代数式表示)
CO(g)+H2(g);ΔH= 。(用含ΔH1、ΔH2的代数式表示) CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验测得相关数据如下图1和图2。
CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验测得相关数据如下图1和图2。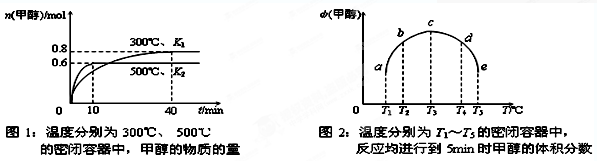
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下pH相同的KOH溶液和K2CO3溶液中由水电离出的c(OH-) |
| B.浓度均为0.1mol·L-1的(NH4)2CO3溶液和(NH4)2SO4溶液中的c(NH4+) |
| C.3 L 0.1 mol·L-1CH3COOH溶液和1L 0.3 mol·L-1CH3COOH溶液中的H+离子数 |
| D.中和pH与体积均相同的NaOH溶液和氨水,所消耗H2SO4的物质的量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g)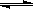 CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应 CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应 |
| B.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除 |
| C.室温下,将浓度为0.1mol.L?1HF溶液加水稀释,其电离平衡常数和c(H+)/c(HF)均不变 |
| D.电解精练铜时,阳极泥中常含有金属金、银、锌等。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.升高温度 | B.加入催化剂 | C.将XQ3及时分离出去 | D.增大反应体系的压强 |
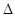 H=-393.5kJ/mol
H=-393.5kJ/mol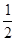 Y2(g)=WY2(g);
Y2(g)=WY2(g);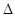 H=-238.0kJ/mol。则 24g W与一定量的Y2反应,放出热量362.5 kJ,所得产物成分及物质的量之比为 。
H=-238.0kJ/mol。则 24g W与一定量的Y2反应,放出热量362.5 kJ,所得产物成分及物质的量之比为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是| A.①② | B.④ | C.③ | D.④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.4.0g碳化硅晶体中所含C—Si数为0.4NA |
| B.PCl3、BF3、HClO这些分子中每个原子都达到了8电子结构 |
| C.电解精炼铜时,当阳极质量减少3.2 g时,电路中转移的电子数为0.1NA |
D.若H+(aq) + OH-(aq)= H2O(l);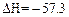 kJ·mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ kJ·mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com